
3.bought
A .through B.although C.rough D.thought
2.failed
A.practiced B.refused C.watched D.waited
第一节:语音知识(共5小题;每小题1分,满分5分)
从A、B、C、D四个选项中,选出可以填入空白处的最佳选项。
1.exsit
A.exercise B.extreme C.example D.expert
32.(22分)雄鸟的性染色体组成ZZ,雌鸟的性染色体组成ZW。某种鸟羽毛的颜色由常染色体上的基因(A、a)和性染色体上的基因(ZB、Zb)共同控制,其基因型和表现型的对应关系如下表:请回答下列问题:
|
基因组合 |
A不存在,不管B存在与否(aa Z-Z- 或aa Z- W) |
A存在,B不存在 (A ZbZb或 A ZbW) |
A和B同时存在 (A ZBZ-或 A ZBW |
|
羽毛颜色 |
白色 |
灰色 |
黑色 |
(1)黑鸟的基因型有 种,灰鸟的基因型有 种。
(2)基因型纯合的灰雄鸟与杂合的黑雌鸟交配,雄配子的基因型是 ,雌配子的基因型是 ,子代中雄鸟的羽色是 ,雌鸟的羽色是 。
(3)用连线法遗传图解对(2)题的结果进行说明:

(4)一只黑雄鸟与一只灰雌鸟交配,子代羽毛颜色有黑色、灰色和白色,则母本的基因型为 ,父本的基因型为 ,黑色、灰色和白色子代的理论分离比为 。
31.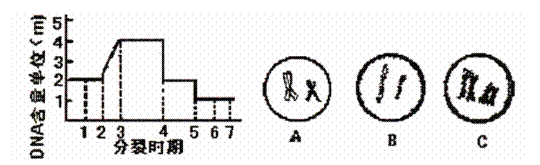 (10分)某雌性动物体细胞中的DNA含量为2个单位(m),下图表示该动物生殖细胞形成过程中细胞核内DNA含量变化的曲线和细胞示意图,请据下图回答问题:
(10分)某雌性动物体细胞中的DNA含量为2个单位(m),下图表示该动物生殖细胞形成过程中细胞核内DNA含量变化的曲线和细胞示意图,请据下图回答问题:
(1)细胞A是 细胞,与之对应的曲线段是 (以横轴上的数字段表示)
(2)细胞B是 ,与之相应的曲线段是 。
(3)细胞C是 ,与之相应的曲线段是 ,C细胞最终能形成 个成熟生殖细胞。
(4)曲线段2-3时期DNA含量变化是由于 的结果,减数第一次分裂时DNA含量变化是由于 的结果,减数第二次分裂时DNA含量变化是由于 的结果。
30.(10分)科学家Mikael为了探究光照强度与光合作用速率的关系,以便为西红柿生长提代最佳的光照强度。实验如下:实验过程:他取几株都有5片叶片的西红柿植株,分别放在密闭的玻璃容器中。实验开始他测定了CO2的浓度,12小时后再次测定CO2的浓度。他还采用7种不同的光照强度,并通过隔热装置使光线通过而热不通过。
实验结果:
|
温度(℃) |
光照强度:普通阳光(%) |
开始时的CO2浓度(%) |
12小时后CO2浓度(%) |
|
25 |
0 |
0.35 |
0.368 |
|
25 |
10 |
0.35 |
0.342 |
|
25 |
20 |
0.35 |
0.306 |
|
25 |
40 |
0.35 |
0.289 |
|
25 |
60 |
0.35 |
0.282 |
|
25 |
80 |
0.35 |
0.280 |
|
25 |
95 |
0.35 |
0.279 |
请你据此分析回答下列问题:
(1)该实验中的自变量是什么? ,说出该实验中的一种控制变量 。
(2)Mikael设计的探究实验在各种光照强度变化中使用了不同株植物。这是一个好的设计吗? ,为什么? 。
(3)在这一实验中Mikael将其中一个装置保持在黑暗中的目的是 。
(4)Mikael对探究结果感到失望。他说“我仍然不能确切地知道哪种光照强度最好? 请你为他的进一步探究提供建议 。
(5)Mikael要用曲线图表示他的实验结果。怎样最好的图示结果?(请在下列四项备选项中选择)( )
A.柱形图,12小时后的二氧化碳浓度与光照强度分别为纵坐标和横坐标
B.柱形图,开始时的二氧化碳浓度与光照强度分别为纵坐标和横坐标
C.曲线图,12小时后的二氧化碳浓度与光照强度分别为纵坐标和横坐标
D.曲线图,开始时的二氧化碳浓度与光照强度分别为纵坐标和横坐标
29.(15分)元素周期表是学习化学的重要工具,它包含了许多的信息和规律。下表是元素周期表的一部分,请从下表①~⑩十种元素中选择适当的元素回答下列问题:
 族 族周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素形成的四核10电子阳离子的化学式为 ,形成的四核18电子分子的化学式为____ _。
(2)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,与元素⑦的性质相似的不同族元素是________(填元素符号)。写出元素③的氢氧化物与NaOH溶液反应的离子方程式___ _ 。
(3)某元素原子的次外层为2个电子,其最高正价与最低负价的代数和为2,则该元素的名称是__ __。另有一元素,其原子的核外电子数等于电子层数。这两种元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构。写出A的电子式 。
A物质与水反应生成一种碱和无色气体,写出有关的化学方程式 ,该反应中的还原剂为 。
(4)物质熔沸点的高低与该物质的晶体结构有关。④的单质晶体熔点为2573K,沸点2823K,硬度大,则属于 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,则B的熔沸点应 (填“高于”或“低于”)NaCl。如果用实验证明上述猜想不正确,你的实验方案是 。
28.(15分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
|
阳离子 |
Ag+
Ba2+ Al3+ |
|
阴离子 |
OH-
Cl-
SO2-4 |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀是减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:A , C ,D ,E 。
(2)A溶液与过量E溶液反应后,最终得到的沉淀的化学式是 。
27.(16分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
26.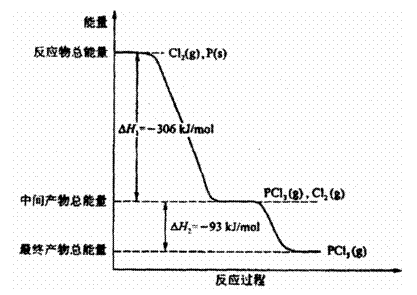 (14分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反复过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
(14分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反复过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
。
(2)PCl5分解成PCl3和Cl2的化学方程式是
。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时,PCl5还剩0.60 mol,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为a2为,a2 a1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是 。
(4)P和Cl2分两步反应生成1 mol PCl5的△H3= 。P和Cl2一步反应生成1mol PCl5的△H4 △H3(填“大于”、“小于”或“等于”)
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com