
18.按右图装置进行实验,并回答下列问题
⑴判断装置的名称:A池为___________ B池为___________
⑵铁极为__________极,电极反应式为_________________________
石墨棒C2附近发生的实验现象为______________________________
⑶当C2极产生2.24L气体(标准状态)时,铁的质量变化(增加或减少)____了 ____g.CuSO4溶液的质量变化(增加或减少)____ 了____g
17.(1)、已知①CO(g) + 1/2 O2(g) =CO2(g) ΔH1= -283.0 kJ/mol
②H2(g) + 1/2 O2(g) = H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3O2(g) = 2CO2 (g) + 3H2O(l) ΔH3=-1370 kJ/mol 试计算④2CO(g)+ 4H2(g)= H2O(l)+C2H5OH(l) 的ΔH4 ?
(2)、镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,镍镉可充电电池中的电解质溶液为KOH溶液,Cd(OH)2、Ni(OH)2、NiO(OH)都难溶于KOH溶液。它的充放电反应按下式进行:


请分别写出该电池在放电及充电时的电极反应式。
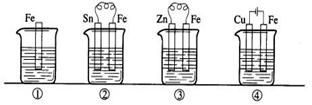
16.(1)、下图各烧杯中盛有海水,铁在其中腐蚀。铁的腐蚀速率由快到慢的顺序为
(2)、已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol发射卫星用肼(即N2H4)的气体为原料,以NO2为氧化剂,两种物质反应生成氮气和水蒸气,试写出该反应的热化学方程式: 。
15.将等质量且过量的a、b两份锌粉装入试管中,分别加入两份同浓度同体积的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是( )

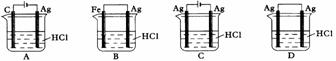
14.某同学为了使反应2HCl + 2Ag 2AgCl +
H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
2AgCl +
H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
13.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.通入丁烷的一极是正极,电极反应为:2C4H10+26e-+13O2- =4CO2+5H2O
C.通入空气的一极是负极,电极反应为:O2+4e-=2O2-
D.电池的总反应是:2C4H10+13O2 ® 8CO2+10H2O
12. 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
11.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
A.CuCl2 [CuSO4] B.NaOH [NaOH] C.NaCl [HCl] D.CuSO4 [Cu(OH)2]
10.已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1)△H=―Q1 KJ/mol 2H2(g)+O2(g)==2H2O(g) △H=―Q2 KJ/mol 2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol 常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少KJ ( )
A.0.4Q1+0.1Q2 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D.0.4Q1+0.05Q3
9.已知热化学方程式:SO2(g)+ 1/2O2(g)
 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为 ( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为 ( )
A. <196.64kJ B. 196.64kJ/mol C. 196.64kJ D. >196.64kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com