
5.离子半径的比较。同族元素相同价态的离子随核外电子层数的增多离子半径增大(F-<Cl-<Br-<I-,Na+<K+<Rb+<Cs+)。核外电了层结构相同的离子随核电荷数的增加,离子半径减小(O2->F->Na+>Mg2+>Al3+)。
例1、A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02gH2,用0.4gA。B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
①写出两种元素的名称A__________,B___________
②用结构示意图表示A、B两元素的常见离子。A__________、B________
解析:红棕色液体为溴单质,则B为溴元素。由An+ + ne = A,可知n=2 ,A的化合价为+2价。
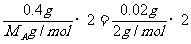 A=40
A=40
答案:①A 钙 B 溴 ②Ca2+ Br-
例2、A、B二种短周期的元素可以形成两种不同的共价化合物C与D。A在化合物C中显-1价,在化合物D中显-2价。化合物C在一定条件下反应产生A的单质。化合物D较为稳定。元素A位于周期表第_______周期,______族;化合物C的电子式______,化合物D的化学式____________。
解析:短周期元素中,显-2价为第ⅥA的元素,只能是氧和硫。在中学化学知识中硫通常无-1价。而氧在过氧化物中显-1价,因此A为氧元素。但C、D均为共价化合物,故C为H2O2,B元素为氢。
 答案:第二周期,第ⅥA族,H O O H、H2O
答案:第二周期,第ⅥA族,H O O H、H2O
例3、现有原子序数之和为51的五种短周元素A、B、C、D、E。已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B属于同一主族;D的最高正价的代数和为4,其最高价氧化物对应的水化物的酸性在同主族元素中最强,E元素最外层电子数与其K层电子数相同。
①试写出它们的元素符号。
②写出B的氢化物的电子式。
③B的气态氢化物与D的气态氢化物互相作用生成的物质,其电子式为_________或___________.
解析:B原子的次外层只能为K层,所以B为氮,C为磷,最高正价和负价的代数和为4时,只有最高正价为+6价,负价为-2价,即ⅥA元素符合,因其含氧酸性为本周期元素的含氧酸中之最强,所以D元素为硫,E为镁,再由原子序数之和为51,而B、C、D、E原子序数均已知,肯定A为氢。
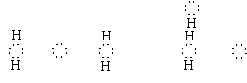 答案:① H、N、P、S、Mg ② H N H
答案:① H、N、P、S、Mg ② H N H
③ [H N H ]+[ S ]2-[H N H]+ 或 [H N H]+[H S ]-
4.非金属元素的原子间可形成离子化合物。如:NH4Cl、NH4NO3、NH4HCO3等。
3.单质分子中的化学键均为非极性键,化合物分子中可有非极键,离子化合物中
 可存在极性键和非极性键。如N?N(N? N叁键为非极键)H-O-O-H(H-O键为极性键,O-O键为非极性键),Na+[ O O]2-Na (O-O键为非极性键,Na+与O2-间为离子键)
可存在极性键和非极性键。如N?N(N? N叁键为非极键)H-O-O-H(H-O键为极性键,O-O键为非极性键),Na+[ O O]2-Na (O-O键为非极性键,Na+与O2-间为离子键)
2.共价化合物中只有共价键,离子化合物中一定含有离子键。如H2O(共价化合物)

 H O O H (由共价键形成),NaOH(离子化合物),Na+[
O H]-(由共价键和离子键形成)。
H O O H (由共价键形成),NaOH(离子化合物),Na+[
O H]-(由共价键和离子键形成)。
1.共价键可存在于单质分子、共价化合物分子和离子化合物中。
 分子
分子
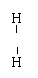


 N2: N N (N=N) Cl2: Cl Cl (Cl-Cl) H2O: H O (H-O)
N2: N N (N=N) Cl2: Cl Cl (Cl-Cl) H2O: H O (H-O)
 CO2: O C O (O=C=O) CH4: H C H (H-C-H)
CO2: O C O (O=C=O) CH4: H C H (H-C-H)
|
项 目 |
概 念 |
对分子的影响 |
|
键 能 |
拆开1摩共价键所吸收的能量或生成1摩共价键所放出的能量 |
键能大、键牢固、分子稳定 |
|
键 长 |
成键的两个原子的核间的平均距离 |
键越短、键能越大,键越牢固,分子越稳定 |
|
键 角 |
分子中相邻键之间的夹角 |
决定分子空间构型和分子的极性 |
定义:原子间通过共用电子对所形成的化学键叫共价键。
说明:①成键元素:通常为非金属元素的原子间。②成键原因:同种或不同种元素的原子之间结合成分子时并不发生电子的完全得失,而是通过共用电子对而结合的。③共价键可以形成单质也可化合物。
同种元素的原子之间形成的共价键称非极性共价键,简称非极性键;不同元素的原子之间形成的共价键称极性共价键,简称极性共价键。
2.化合物
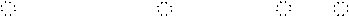 K2S: K+[ S ]2-K+、 CaO: Ca2+[ O ]2-、 CaF2: [ F ]-Ca2+[ F ]-;
K2S: K+[ S ]2-K+、 CaO: Ca2+[ O ]2-、 CaF2: [ F ]-Ca2+[ F ]-;
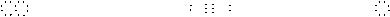 Na2O2: Na+[ O O ]2-Na+、 CaC2: Ca2+[ C C ]2-、 NaOH: Na+[ O H]-
Na2O2: Na+[ O O ]2-Na+、 CaC2: Ca2+[ C C ]2-、 NaOH: Na+[ O H]-

NH4Cl: [H N ]+[ Cl ]-
1.离子
单核阳离子符号,即为阳离子的电子式,如H+、K+、Na+、Mg2+;原子团的阳离子:
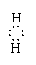
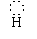
 [H N
H]+、 [H O H]+,单核阴离子:[H ]-、[ O ]2-、[ Cl ]-、;原子团的阴离子:
[H N
H]+、 [H O H]+,单核阴离子:[H ]-、[ O ]2-、[ Cl ]-、;原子团的阴离子:
[ O H]-、[ S S ]2-、[ C C ]2-、[ O O ]2-。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com