
3.离子方程式的意义
2.离子方程式的正误判断规律(七“看”):
 ⑴
看离子反应是否符合客观事实;
⑴
看离子反应是否符合客观事实;
⑵ 看“ ”、“ ”、“↑”、“↓”等是否正确;
⑶ 看表示各物质的化学式是否正确。如HCO3-不能写成H++CO32-、HSO4-通常写成H++SO42-,HCOO-不可写成COOH-。只有既易溶解于水又能完全电离的化合物(强酸、强碱、可溶性盐)才能拆成离子形式;
⑷看是否包含所有参加离子反应的离子。如Ba(OH)2溶液与硫酸铜溶液反应,既要写Ba2+与SO 的离子反应,又要写Cu2+与OH-的离子反应。
的离子反应,又要写Cu2+与OH-的离子反应。
⑸ 看是否满足三守恒。如FeCl2溶液与Cl2反应,不能写成
Fe2++Cl2 === Fe3++2Cl-,而应写成
2Fe2++Cl2 === 2Fe3++2Cl-。
⑹ 看反应物或产物的配比是否正确。如稀H2SO4与Ba(OH)2溶液反应不能写成
H++OH-+SO +Ba2+=== BaSO4↓+H2O,应写成
+Ba2+=== BaSO4↓+H2O,应写成
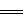 2H++2OH-+SO
2H++2OH-+SO +Ba2+ BaSO4↓+2H2O。
+Ba2+ BaSO4↓+2H2O。
⑺ 看题设条件中反应物的量(如:“少量”、“过量”、“足量”、“等物质的量”、 “适量”、“任意量”等)以及滴加顺序等对反应方式或产物的影响。
1.离子方程式的书写
⑴ 改写原则:
① 强酸、强碱和大多数可溶性盐改写成离子形式;弱酸、弱碱、难溶性盐、单质、非电解质气体、水、氧化物、有机物(不包括可溶性的有机盐)等写成化学式;
② 微溶物:作反应物时,若是澄清溶液写成离子符号,若是浊液则写成化学式;
作生成物时,一般写成化学式(且用“↓”)。
③ 氨 水:作为反应物:一般写成NH3·H2O;
作为生成物,若有加热或浓度很大时,可写成NH3(一般用↑)。
④ 多元弱酸酸式酸根离子,在离子方程式中不能拆开写。
⑤ 不在水溶液中进行的离子反应,不能写成离子反程式。如:固体与固体反应不能写成离子方程式,浓硫酸、浓磷酸与固体反应一般不用离子方程式表示。
⑵ 守恒原则 :
离子方程式必须同时满足原子质量守恒和电荷守恒,氧化还原反应的离子方程式还应满足得失电子守恒。
22.4L 172 g
1×104×103×0.2%L m(CaSO4·2H2O)×103 可解得m(CaSO4·2H2O)=153.6 kg
(2)应用极端法进行推断可知,16.7g是Na2SO3 与NaHSO3的混合物。
设混合物中NaHSO3的物质的量为a , Na2SO3的物质的量 为b ,则
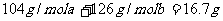 (质量守恒)及
a+ 2b = 0.2 mol (Na+守恒)
(质量守恒)及
a+ 2b = 0.2 mol (Na+守恒)
联解得a=0.1mol ,b=0.05mol
(3)可借用数轴进行分析讨论:由反应式可知两个界点,n(SO2) / n(NaOH)=1/2和
n(SO2) / n(NaOH)=1 。
反应 (Ⅰ) (Ⅰ)和(Ⅱ) (Ⅱ)
产物 Na2SO3 Na2SO3 与NaHSO3 NaHSO3

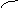
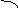

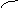
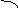




 1/2
1
1/2
1
讨论结果为
|
x |
n(NaHSO3) |
|
0<x≤1/2 |
0 |
|
1/2<x<1 |
n(NaHSO3)=2
n(SO2)-n(NaOH) |
|
x≥1 |
n(NaHSO3)=n(NaOH) |
12.(1)由硫原子守恒可行关系式:
SO2 - CaSO4·2H2O
11.(1)联合制碱法或侯德榜制碱法 化肥或电解液或焊药等(其他合理答案均给分)
(2)NH3 + CO2 + H2O + NaCl → NH4Cl + NaHCO3↓
或 NH3 + CO2 + H2O → NH4HCO3 NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
(3)CO2 (4)I 过滤 (5)稀硝酸和硝酸银溶液 (6)a、c
10.(1)450℃ 在450℃时SO2的转化率明显高于550℃,且在该温度条件下催化剂的催化活性最大。(2)1 atm 该条件下SO2的转化率已高达97.5%,与加压时SO2的转化率相比相差无几,常压可节省动力,简化设备。(3)用水吸收SO3易形成酸雾,吸收速率慢,效率低。(4)氨水 硫酸 2NH3+H2O + SO2= (NH4)2SO3 (NH4)2SO3+H2SO4= (NH4)2SO4+SO2↑+H2O
3.(1)M1+M2= (说明:其它合理解法也可以)
(说明:其它合理解法也可以) (2)增大
(2)增大
课后练习:1.CD 2.C 3.D 4.C 5.A 6.B 7.B 8.A 9.D
6.23×105kJ能量。(3)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2
(4)SO2 转化为SO3是正反应放热的可逆反应,随温度升高,平衡向逆反应方向移动,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,所以CuSO4的量减少)。
12、(1997年上海,36)接触法制硫酸排放的尾气中含少量的SO2,为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的10,000m3尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、
石灰及O2处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL 2mol/L的NaOH溶液中使其完全反应,经测定所
得溶液含16.7 g溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3 。调节尾气排放的流量,以
取得SO2与NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且n(SO2) / n(NaOH)=x ,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
第45讲
典例解析
[例1]矿石不粉碎只是燃烧速率慢且不充分;净化炉气是为了防止混有的杂质使催化剂中毒,以及水蒸气对设备的腐蚀;因SO3极易与水反应,用水或稀硫酸吸收SO3时会形成大量的酸雾,影响吸收,而98.3%的浓硫酸的液面上基本没有水蒸气,故用它来吸收 SO3;热交换器中冷、热气体逆流,始终保持一定的温度差,使热的传递有较大的动力,热交换充分。本题答案选CD。
[例2]B
当堂反馈:1.D 2.(1)C (2)由关系式和热化学方程式可知,生产1t 98%硫酸能放出热量9.83×105kJ,则9.83×105kJ -3.6×105kJ=6.23×105kJ,即可向外界输出

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com