
[例1]在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是( ) [答案]C
A. 单位时间内生成n mol的A2同时生成n mol AB。
B. 容器内的总压强不随时间变化
C. 单位时间内生成2n mol的AB,同时生成n mol的B2。
D. 单位时间内生成n mol A2同时生成n mol B2。
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
[例2](06盐城三模)甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法
是采用CuO-ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 CH3OH ,工艺中一些参数如下图;目前正在开发的新法 2CH4+O2 2CH3OH,下列有关新法和旧法的说法正确的是 AC
A.旧法生产中,由图知CO与H2合成甲醇的
反应属于放热反应
B.旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势
C.新法与旧法相比,原料丰富并可直接从天然气中获得
D.新法生产中,需控制V(CH4)/V(O2)=9︰1,目的是提高空气中氧气的转化率
[例3]100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是:①烧瓶内气体的颜色不再加深,②N2O4 的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体的平均相对分子质量不再变化。
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
[例4]化工生产在遵循科学原理、实现某个化学反应的基础上,必须考虑综合经济效益,最大限度的降低成本,提高劳动生产率,保护生态环境。以下是对合成氨工业和硫酸工业的综合经济效益的考虑:① 合成氨工业应采用尽可能高的压强以提高反应物的转化率,② 考虑到反应速率和催化剂的催化活性,合成氨反应和二氧化硫的催化氧化一般都选择在500℃ 左右的温度下进行,③ 合成氨工业中从平衡混合物里分离出的氮气和氢气应循环使用,④ 合成氨工业中的原料气之一氢气常采用电解水的方法制取,⑤ 两工业中均应考虑充分利用反应本身放出的热量,⑥ 硫酸工业中为节约成本,从沸腾炉中出来的炉气应直接进入吸收塔,⑦ 硫酸工业中应用98.3%的浓硫酸吸收三氧化硫,⑧ 硫酸工业的尾气应使用氢氧化钠溶液吸收。其中合理的是
A. ②⑤⑥⑦ B.①④⑥⑧ C.③④⑦⑧ D.②③⑤⑦
7.勒沙特列原理:
1.影响化学平衡的外界条件:对于某一可逆反应mA(气)+nB(气) pC(气)+qD(气)达平衡时,条件变化与速率、平衡移动的关系可归纳如下:
|
条件变化 |
反应特征 |
化学反应速率 |
υ正与υ逆的关系 |
平衡移动的方向 |
备注 |
|
|
υ正 |
υ逆 |
|||||
|
增大A 浓 度 |
可逆反应 |
|
|
|
|
①固态物质的增加或减小,对平衡移动 影响 ②生产中一般采用增大廉价原料浓度提高 价原料利用率 |
|
增大C 浓 度 |
|
|
||||
|
减小A 浓 度 |
可逆反应 |
|
|
|
|
|
|
减小C 浓 度 |
|
|
||||
|
增大压强 |
m+n=p+q |
|
|
|
|
①恒温下,增容等于 压,否 则反之 ②恒温恒容下,加入惰性气体,平衡 移动 ③恒温恒压下,加入惰性气体,平衡向气体总体积 的方向移动 |
|
m+n>p+q |
逆 |
|
||||
|
m+n<p+q |
|
|
||||
|
减小压强 |
m+n=p+q |
|
|
|
|
|
|
m+n>p+q |
|
|
||||
|
m+n<p+q |
|
|
||||
|
升高温度 |
△H<0 |
|
|
|
|
①温度的变化对反应速率一定 影响 ②改变温度,反应物的转化率一定升高(或降低),生成物的含量 增大(或降低) |
|
△H>0 |
|
|
||||
|
降低温度 |
△H<0 |
|
|
|
|
|
|
△H>0 |
|
|
||||
|
正催化剂 |
任何反应 |
|
|
|
|
使用催化剂 使化学平衡发生移动,但可 到达平衡的时间 |
|
负催化剂 |
|
|
|
|
5.化学平衡的移动:已达平衡的可逆反应,由于 的改变,原平衡被 ,各组成 ,使其在 恒定的情况下建立起 。这种由原条件下的 向新条件下的 的转化过程,称为化学平衡的移动。
⑴ 导致化学平衡移动的原因: 。
⑵ 平衡移动方向的判断:① 外界条件改变导致 ,原平衡正向移动;② 外界条件改变导致 ,原平衡逆向移动;③ 外界条件改变导致v(正)、v(逆)变化,但变化的 ,变化过程中始终保持 ,平衡不移动。
4.可逆反应到达平衡状态的标志
⑴ 本质标志通常有三种:①
②
③
⑵ 其他标志:① 各组分的物质的量、 、 不随时间的改变而改变;② 对于有颜色气体参加的反应,混合气体 不随时间改变而改变;③ 恒温、恒容时,对于反应前后气体总体积不等的反应, 不再改变、混合气体的 不再改变;④ 恒温、恒压时,对于反应前后气体总体积不等的反应, 不再改变、混合气体的 不再改变;⑤ 对于吸热或放热反应,绝热体系的 不随时间的改变而改变;等等。
2.化学平衡状态
化学平衡状态特征有
1.化学平衡的研究对象是
1、可逆反应 的反应。如: 。
不可逆反应 的反应。如:
[例1]下列离子方程式正确的是
A.Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.Mg(HCO3)2溶液中加入足量NaOH溶液: Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
C.苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
D.等物质的量浓度的Ba(OH)2溶液与明矾溶液以体积比3比2混合 3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
E.3 mol的Cl2 通入含2 mol FeI2的溶液中;2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2
F. 甲醛溶液中加入足量的银氨溶液并加热: HCHO+2[Ag
(NH3)2] ++2OH-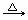 HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O
G.Na2S溶液呈碱性:S2-+2H2O = H2S+2OH-
H.将1-2mL氯化铁饱和溶液加入到20 mL沸水中: Fe3++3H2O== Fe(OH)3(胶体)+3H+
I.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀:
AlO2-+HCO3-+H2O=Al(OH)3↓+CO2↑
J.H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑ [例2]将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是 ( )

A B C D
[例3]已知,同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS >H2S>CuS,则以下离子方程式错误的是
A.Mg2++2 HCO3-+2Ca2++4 OH- = Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S = CuS↓+2H+
C.Zn2++S2-+2H2O = Zn(OH) 2↓+H2S↑
D.FeS+2H+ = Fe2++H2S↑
[例4]工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往一业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排入标准。
请回答下列问题:
(1) 两极发生反应的电极反应式 阳极:___________________________
阴极:__________________________
(2) 写出Cr2O72-变为Cr3+的离子方程式:____________________________________
(3) 废水由酸性变为碱性的原因是__________________________________________
(4) ____________(填“能”或“不能”)改用石墨电极,原因是________ ____ 。
4.考点探究
离子方程式的正误判断一般出现在高考试题的第Ⅰ卷中,从近几年的高考试题来看,所给离子方程式中的错误通常有:不能正确使用分子式与离子符号,反应前后电荷不守恒,得失电子数不守恒,反应原理不正确,缺少必要的反应条件,不能正确使用可逆号,忽略反应物用量的影响等。在解答过程中要注意理清思路,按序判断。
离子方程式的书写一般出现在高考试题的第Ⅱ卷中,与元素化合物推断题或离子推断题综合在一起进行考查。解此类题的方法思路是:先明确实质即根据离子反应发生的条件,分析找出参加反应的离子;然后再抓住关键即由参加反应的离子的来源、物质的性质(如电离程度、溶解性、单质、气体等),确定是写化学式还是写离子符号。从高考试题的表现形式来看,除考查中学化学教材中所涉及的典型的离子反应方程式的书写外,越来越注重有关知识迁移应用的考查即信息给予题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com