
3.(2005江苏) 已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A、3Cl2+6FeI2=2FeCL3+4FeI3 B、Cl2+FeI2=FeCl2+I2
C、Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D、2Fe3++2I-=2Fe2++I2
2.(2005全国I)下列说法中正确的是
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
[例] 金矿和银矿中金银的含量往往较低,工业上提炼金是采用氰化法提炼。这个方法的原理是:用稀的氰化钠溶液处理粉碎了的金矿石,通空气,使金矿石中的金粒溶解, 生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:
4Au+8NaCN+2H2O+O2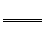 4Na[Au(CN)2]+4NaOH
4Na[Au(CN)2]+4NaOH
Na[Au(CN)2]在水溶液中电离为Na+和[Au(CN)2]-。电离方程式为: N a[An(CN)2]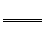 Na++[An(CN)2]-,然后再用锌从溶液中把金置换出
来,锌转化为Na2[Zn(CN)4]。请回答下列问题:
Na++[An(CN)2]-,然后再用锌从溶液中把金置换出
来,锌转化为Na2[Zn(CN)4]。请回答下列问题:
(1)写出在空气中用氰化钠溶液提取金的电极反应式。(2)写出锌从溶液中置换出金的离子方程式。
[解析] 这道题目看起来比较生疏,但认真审清题意,不难发现,用氰化钠溶液,通入空气溶解金的原理,与钢铁的吸氧腐蚀原理完全相似。写出锌和Na[Au(CN)2]发生置换反应的离子方程式,主要是根据题目给出的信息得出Na[Au(CN)2]是强电解质。
(1)负极4Au+8CN--4e-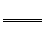 4[Au(CN)2]-
4[Au(CN)2]-
正极O2+2H2O+4e-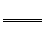 4OH-
4OH-
(2)Zn+2[Au(CN)2]-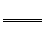 [Zn(CN)4]2-+2Au↓
[Zn(CN)4]2-+2Au↓
智能训练
1.(2005全国I)等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则在C的生成物中,该金属元素的化合价为
A.+1 B.+2 C.+3 D.+4
2、常见金属的冶炼方法
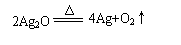
 (1)热分解法:适合冶炼金属活动性 的金属(例如Hg和Ag)。
(1)热分解法:适合冶炼金属活动性 的金属(例如Hg和Ag)。
(2)热还原法:用还原剂( 等)还原金属氧化物(金属活动性在Zn~Cu之间) 。

 (3)电解法:冶炼金属活动性 的金属(例如钠、镁、铝等)。
(3)电解法:冶炼金属活动性 的金属(例如钠、镁、铝等)。
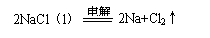

(4)淘取法:适合以游离态存在的密度 的金属(例如金等)。所得金属纯度不高,需精炼。
1、金属元素概述
(1)金属的通性
①物理性质:常温下,绝大多数金属是固体,呈 色。金属一般具有
②化学性质:金属元素原子一般最外层电子数 4,而且原子半径比同周期的非金属原子半径 ,故金属原子易 电子显 。
③特性:a.地壳中含量最多的金属元素是 ;
b.金属中有液态,例如 ,它是熔点最低的金属;
c.最活泼的金属元素是 ,最稳定的金属是金。
④影响金属晶体熔沸点高低和硬度的因素
金属离子半径越 ,电荷价数越 ,金属离子和自由电子的作用力越 ,熔沸点越高,硬度越大。例:硬度Al Mg,熔点Al Mg。
(2)由金属活动性顺序表分析金属知识的规律
|
金属活动性顺序表 |
K
Ca Na |
Mg
Al Zn Fe Sn Pb |
(H) |
Cu
Hg Ag |
Pt
Au |
|
 金属原子失去电子的能力(还原性) 金属原子失去电子的能力(还原性) |
|
|||||
 金属阳离子得到电子的能力(氧化性) 金属阳离子得到电子的能力(氧化性) |
|
|||||
|
与氧气化合 |
常温下易被氧化 |
常温下缓慢被氧化 |
|
加热被氧化 |
不能 |
|
|
置换水中H+ |
常温下能置换 |
加热时能置换 |
|
不能置换 |
||
|
置换酸中H+ |
能置换 |
|
不能置换 |
|||
|
与盐溶液反应 |
先与水反应 |
前面的金属置换后面的金属 |
||||
|
自然界中存在 |
化合态 |
化合态和游离态 |
游离态 |
|||
|
冶炼方法 |
|
|
|
|
||
1.(2)2:1
(3)3〈a〈1.9
(4)BC
12、(1)不可能
12、(06盐城三模)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)
|
2SO2(g)+O2(g)
2SO3(g) |
|
N2(g)+3H2(g)
2NH3(g) |
⑴若其始时左侧投入2molSO2、1molO2,右侧投入1molN2、4molH2,达到平衡后(两侧温度相同),隔板是否可能在、仍处于中央 (填“可能或不可能”)
⑵起始时投入2molSO2、1molO2;1molN2、2molH2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字)
⑶若起始时投入2molSO2、1molO2;1molN2、amolH2、0.1molNH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围
⑷若起始时投入2molSO2、1molO2,欲用简单方法粗略测定平衡时SO2的转化率,则可将左侧的平衡混合气体中通入足量的 (填序号)
A、碳酸钠与碳酸氢钠混合溶液 B、氯化钡溶液
C、98.3%的浓硫酸 D、硝酸钡混合溶液
11、⑴任意(2分) ⑵n(D)>0.8(2分)
⑶当升高到一定温度以后,D渐渐转化为气态(2分)
Mr(A)+2Mr(B)==3Mr(C)+2Mr(D)(2分)
⑷①气体物质两边的化学计量数相等,增大压强不改变平衡状态。(1分)
②B渐渐转化为非气态,增大压强平衡向左移动。(1分)
③C渐渐转化为非气态,增大压强平衡再次向右移动。(1分)
11、(06宿迁二模)在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g) 3C(g)+2D(s);ΔH<0。达到平衡时生成了1.8 mol C。
⑴在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
⑵若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D) mol。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生重大影响。
⑶若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:
;此时A、B、C、D四种物质相对分子质量之间的关系为 (用Mr(A)、Mr(B)、Mr(C)、Mr(D)表示)。
⑷若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com