
3.(2002年全国理综,6)以下说法正确的是
A.纳米材料是指一种称为“纳米”的新物质制成的材料
B.绿色食品是指不含任何化学物质的食品
C.生物固氮是指植物通过叶面直接吸收空气中的氮气
D.光导纤维是以二氧化硅为主要原料制成的
2.下列各项叙述的解释原因相同的是
①NaOH溶液不能用带玻璃塞的试剂瓶保存;②Na2SiO3溶液要密封保存;③酸式滴定管不能装NaOH溶液;④氢氟酸不能盛放在玻璃瓶中。
A.①② B.①③ C.①④ D.②③
1.过量的泥沙、纯碱和生石灰共熔后可生成
①水泥 ②玻璃 ③瓷器 ④混凝土 ⑤一种硅酸盐产品
A.①和④ B.②和⑤ C.③ D.②
[例1]下列说法正确的是
A. 二氧化硅溶于水显酸性 B.二氧化碳通入水玻璃可以得到原硅酸
C.因为高温时SiO2与Na2CO3反应放出CO2,所以硅酸的酸性比碳酸的酸性强
D.二氧化硅是酸性氧化物,它不溶于任何酸
[例2]随着科技的飞速发展,出现了许多新型无机非金属材料,如植入生物体内的生物陶瓷材料HAP[化学式为Cam(PO4)n(OH)2] ,已被医疗上用于修补人的骨和牙组织。HAP的化学式中m等于
A.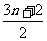 B.
B.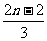 C.
C.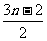 D.n+1
D.n+1
[例3]据报导我国科学家近年来研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是
A.它耐高温抗氧化 B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点 D.它是一种新型无机非金属材料
6、无机非金属材料
(1)分类:①传统无机非金属材料:水泥、玻璃、陶瓷等硅酸盐材料。
②新型无机非金属材料:半导体材料、超硬耐高温材料、发光材料等。
(2)新型无机非金属材料的特性
①耐高温、强度高;②具有电学特性;③具有光学特性;④具有生物功能。
(3)重要的新型无机非金属材料:
①高温结构陶瓷(有氧化铝陶瓷:又称人造刚玉,具有熔点很高、硬度高的优点。可用于作坩埚、高温炉管、球磨机、高压钠灯的灯管等。、氮化硅陶瓷:具有硬度极高、耐磨损、抗腐蚀和抗氧化能力等优点。可用于制造轴承、汽轮机叶片、机械密封环、永久性模具、发动机部件等。、碳化硼陶瓷具有熔点高、硬度大的优点。广泛应用于工农业生产、原子能工业、宇航工业等);高温结构陶瓷的优点:能经受高温、不怕氧化、耐酸碱腐蚀、硬度大、耐磨损、密度小等。
②光导纤维(光纤) 光导纤维的特点:传导光的能力非常强,抗干扰性能好,不发生电辐射等。光导纤维的应用:通讯、医疗、信息处理、传能传像、遥测遥控、照明等。
5、硅酸盐工业
(1)水泥
原料: 。
生产设备: 。
主要成分: 。
水泥是一种混合物,它的水硬过程是一个复杂的 过程。
(2)玻璃
原料: 。
生产设备: 。
反应原理: 。
主要成分: 。
(3)陶瓷
主要原料: 。
主要生产过程: → → → → 。
主要设备: 。
主要性质:抗氧化,抗酸碱腐蚀,耐高温,绝缘,易成型等。
4、 硅和二氧化硅及硅酸的特殊性
①硅的还原性比碳强,而碳在高温下却能从二氧化硅中还原出硅。
②非金属单质一般不与弱氧化性酸反应,而硅不但能与氢氟酸反应,而且还有氢气生成。
③非金属单质与强碱溶液反应一般不生成氢气,而硅却能与强碱溶液反应生成氢气。
④虽然二氧化硅是硅酸的酸酐,但却不能用它与水直接反应制备硅酸,而只能用可溶性的硅酸盐与酸作用来制备。
⑤酸性氧化物一般不与酸反应(除氧化还原反应外),而二氧化硅却能与氢氟酸反应。
⑥非金属氧化物一般是分子晶体,而二氧化硅却是原子晶体。
⑦无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。
3、硅酸及硅酸盐的性质
①原硅酸和硅酸均不溶于水,其酸性比碳酸弱(注意:不能用水和二氧化硅直接反应制H2SiO3 )。原硅酸(H4SiO4)很不稳定,在空气中易失水生成硅酸,其反应式为:H4SiO4==H2SiO3+ H2O。硅酸加热后会发生分解生成SiO2和H2O。
②Na2SiO3的水溶液俗称水玻璃,置于空气中会变持,其反应的化学方程式为:
Na2SiO3 + CO2 +2H2O== H4SiO4↓+Na2CO3 (酸性比碳酸弱)。
2、二氧化硅
(1)硅晶体的结构与主要物理性质
晶体的结构:晶体二氧化硅是硅原子和氧原子以 键形成的 状的 晶体,因此二氧化硅硬度 ,熔点 , 导电, 溶于水。
(2)二氧化硅的化学性质
二氧化硅中的硅处于硅元素的最高价+4,反应中只能降低,得电子表现弱氧化性(与焦炭、镁等反应)和酸性氧化物的通性,它是H2SiO3和H4SiO4的酸酐,能与碱性氧化物反应,如:SiO2 + CaO == CaSiO3 ;能与强碱反应,如:SiO2 + 2NaOH== Na2SiO3 + H2O,所以盛放碱性溶液的试剂瓶不能用玻璃塞,只能用橡皮塞;能与氢氟酸剧烈反应:SiO2 + 4HF = SiF4↑+ 2H2O,故氢氟酸应保存在塑料瓶中。
1、硅及其重要化合物
(1)硅元素的含量与存在
在地壳里,硅的含量在所有元素中居第 位,仅次于 ,全部以 态形式存在,是构成矿物和岩石的主要元素。
(2)硅晶体的结构与主要物理性质
晶体,具有 体的空间网状结构; 色,有金属光泽;硬度 ,熔沸点 ,但都低于金刚石,是良好的半导体材料。
(3)硅的化学性质
在常温下化学性质稳定,只能与氟气、氢氟酸和强碱溶液反应:
Si+2F2=SiF4
Si+4HF=SiF4+2H2
Si + 2NaOH + H2O == Na2SiO3 + 2H2↑(该反应的氧化剂是H2O,还原剂是Si)
(4)高纯硅的制法
 工业上,用碳在高温下还原二氧化硅制得含有少量杂质的粗硅,反应的化学方程式为
工业上,用碳在高温下还原二氧化硅制得含有少量杂质的粗硅,反应的化学方程式为
2C + SiO2 (制粗硅)

 Si+2Cl2 (提纯)
Si+2Cl2 (提纯)
 SiCl4+H2 (还原)
SiCl4+H2 (还原)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com