
2.(2001年全国,4)为了保护臭氧层,可采取的有效措施是
A.减少二氧化硫的排放量 B.减少含铅废气的排放量
C.减少氟氯代烃的排放量 D.减少二氧化碳的排放量
1.(2004年江苏,3)2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球--科学发展”。下列行为中不符合这一主题的是
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.节约能源,提高能源利用率
[例1](2005年广东,18)背景材料:① 2004年夏季,特氟隆不粘锅事件引起公众关注;② 2004年冬季,诺贝尔化学奖授予研究蛋白质的科学家;③ 2005年初春,广东大部分进行了人工降雨;④ 2005年春末,某高速公路发生液氯运输车翻倒泄漏事故。下列相应说法正确的是
A.特氟隆(聚四氟乙烯)的单体是氟利昂
B.蛋白质是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔现象
C.AgI和干冰都可用于人工降雨
D.附近人员应迅速远离液氯泄漏地点,并逆风往安全区域疏散
[例2](2000年全国,1)导致下列现象的主要原因与排放SO2有关的是
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
[例3](1998年上海,28)汽车尾气(含有碳氢化合物、CO、SO2、NO等物质)是城市空气的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化剂转换器”(用铂钯合金作催化剂)。它的特点是使CO和NO反应,生成可参与大气生态环境循环的无毒气体,并促使碳氢化合物充分燃烧及SO2的转化。
(1)写出CO和NO反应的化学方程式____________________________________。
(2)“催化剂转换器”的缺点是在一定程度上提高空气的酸度,其原因是
________________________________________________________。
(3)控制城市污染源的方法可以有_______________
A.开发能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
4、能源
(1)能源的分类:常规能源(可再生能源,例水等;非再生能源,如煤、石油、天然气);新能源(可再生能源,如太阳能、风能、生物能;非再生能源,如核聚变燃料)。
(2)新型化学电源:碱性蓄电池、银锌电池、燃料电池等。
(3)能源的开发:①太阳能:每年辐射到地球表面的能量为50×1018kJ,相当于目前全世界能量消费的1.3万倍。②生物能:将生物转化为可燃性的液态或气态化合物,再利用燃烧放热。③风能:利用风力进行发电、提水、扬帆助航等技术,风能是一种可再生的干净能源。④地球能、海洋能等。
3、部分有关环境保护的知识
(1)中学常见污染环境的气体及其防治 SO2 工业上用浓氨水吸收,实验室用NaOH吸收。 NOx 用NaOH溶液吸收。 H2S 用NaOH溶液吸收。 Cl2、Br2、HCl:用碱液吸收,Cl2、Br2还可用Na2S03吸收。 CO 用燃烧的方法除去。 (2)全球环境三大问题 ①“酸雨”。“酸雨”主要是由硫酸、硝酸造成的,我国的“酸雨”主要是硫酸型的。“酸雨”的形成需要有一定的环境气候和地理因素。形成过程一般认为SO2等酸性气体进入大气后造成局部地区大气中S02的富集 H2S04,随雨水降下形成“酸雨”。 ②臭氧层的破坏。 破坏臭氧层的主要有害物质是:氮氧化物和氯氟烃等。反应机理: N2O+hv =N+NO CF2Cl2+hv= Cl+CF2Cl O3 +NO= O2 +NO2 O+NO= O2+N O+ClO =C1+O2 总反应式O+O3 =2O2 从以上反应和总反应式看出,有害物质NO、活性C1都未消耗,均起着催化剂的作用。 ③温室效应 C02、O3、CH4等气体虽不影响太阳对地球表面的辐射,但能阻碍由地面反射回高空的红外辐射,这就像给地球罩上一层保温膜,使地球表面的气温增加,产生温室效应。 温室效应对人类生活会带来很大影响。可能导致地球两极冰川融化,使海平面升高,淹没世界上许多城市。此外,地球表面气温升高,各地降水和干湿状况也会发生变化,导致土地沙漠化。在温室效应和臭氧层消耗的共同影响下,还会造成气候的反常,如厄尔尼诺现象等,导致动物反常迁移,植物反常生长,甚至动植物种类的消失等
2、造成环境污染的物质及其来源
(1)二氧化硫:大量的二氧化硫主要来源于煤和石油的燃烧、金属矿石的冶炼等。
(2)氮的氧化物:主要来自于煤、石油等燃料的燃烧和使用硝酸的工厂以及汽车等排放的废气等。③碳的氧化物:主要来自于煤、石油等燃料的燃烧。
(3)工业尾气及其主要成分
①硫酸厂尾气:主要成分为SO2、O2、N2,一般用氨水吸收其中的在害成分。
②硝酸厂尾气:主要成分为NOx、O2、N2,一般用NaOH溶液吸收其中的有害成分。
③高炉煤气:主要成分为CO、CO2、N2,一般回收利用。
④炼钢(棕色)烟气:主要成分为Fe2O3烟尘、CO,一般回收利用。
焦炉气:主要成分为H2、CH4、CO、CO2、C2H4、N2,可用作燃料。
⑤氯碱工业:主要成分为Cl2,一般用NaOH溶液吸收。
化学研究和应用的一个重要目标就是开发和利用自然界中一切可能的物质资源和能量资源,为人类生存和社会发展提供必要的物质和能源基础;同时,应该注意到这一过程必须同自然环境相互协调,走可持续发展的道路。化学与可持续发展,主要包括相辅相成的两个方面,一是利用化学变化不断地提供人类生存和发展的物质条件(主要包括获得有用物质和获得能量),利用化学变化还可以创造自然界原本没有的物质(主要指有机合成高分子化合物),从而使生活更加方便、舒适;二是在开发自然资源的过程中,必须深刻地认识到保护周围环境、维护生态平衡的重要性,建立可持续发展的观念。
1、环境污染及保护
(1)环境污染
①大气污染:汽车尾气(主要有害成分为CO、NOx、SO2、碳氢化合物等)、光化学污染(碳氢化合物和NOx等一次污染物以及它们在紫外线照射下发生反应生成的二次污染物共同形成的烟雾污染)、酸雨(由NOx、SO2引起)、温室效应(由SO2引起)、臭氧层空洞(由氟里昂等引起)。②水体污染:有毒无机污染物(指Ba2+、Pb2+、Hg2+、Cd2+等重金属离子以及CN -、NO2-等)、有毒有机污染物(指有机氯农药、多氯联苯、多环芳烃等)、含氮、磷化合物(引起水体富营养化)、生活污水中大量耗氧有机物(含磷洗涤剂)等。
③食品污染:农药、食品添加剂。④固体废弃物等。
环境保护:关键是杜绝污染源。
20.(1)BrCl3+2SO2+4H2O=HBr+3HCl+2H2SO4 (2)3
提示:由质量守恒定律可知n(Ag+)=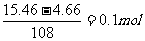 ,则有
,则有
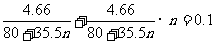 ,求得n=3
,求得n=3
19.72.3%
提示:本题为无数据计算题。根据质量守恒有:m (KI溶液) + m (AgNO3溶液)
= m (AgI) + m (KNO3溶液) ,因为m (KI溶液)= m (KNO3溶液) ,所以m (AgNO3溶液)
= m (AgI) ,又因为是恰好完全反应,故n(AgNO3)= n (AgI) ,因此AgNO3溶液中溶质的质量分数为: 。
。
18.(1)Fe Cl2 H2 (2)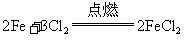 (3)2HCl+Fe =
FeCl2+H2↑ (4)2
FeCl2+Cl2 = 2FeCl3
(3)2HCl+Fe =
FeCl2+H2↑ (4)2
FeCl2+Cl2 = 2FeCl3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com