
1、碳族元素的组成和结构
①碳族元素包括:碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅( Pb)5种元素,位于元素周期表的ⅣA族。
②碳族元素原子最外层有4个电子,其最高正价为+4价,最高价氧化物及其水化物的化学式分别表示为RO2、H2RO3或H4RO4或R(OH)4,气态氢化物的化学式表示为RH4。随着原子序数的增大,碳族元素的原子半径依次增大。
③碳族元素由于位于活泼的金属向活泼的非金属过渡的中间位置,故在化学反应中不易得到或失去电子,易形成共价键,难形成离子键。碳元素形成的单质(金刚石)硬度最大;碳元素形成的种类最多;在所有非金属形成的气态氢化物中,甲烷中氢元素的质量分数最大;硅在地壳中的含量仅次于氧,其单质的晶体是一种良好的半导体材料。
21 氯气通入石灰乳中得漂白粉,其主要成份是Ca(OH)2. 3CaCl(ClO). nH2O ,现有一种漂白粉的有效氯(过量HCl和漂白粉作用生成氯气的质量和漂白粉质量之比)为35%,若漂白粉的组成和上述化学式相符,则式中n值是多少?
课堂练习答案
11答案:⑴②;⑵②;⑶③⑤;⑷液封⑸干燥剂⑹将燃着的木条靠近瓶口,如果熄灭了,证明收集满了。
13(1)Fe;CI2;Cu
(2)产生棕黄色的烟;
(2) 2Fe2++Cl2==2Fe3++2Cl-
(3) 2 Fe3++Cu==2Fe2++Cu2+
(4)
Cu2++2H2O
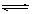 Cu(OH)2+2H+
Cu(OH)2+2H+
14V(HCl)=352.8L
15 56.30
课后练习答案
17选题目的:本题考查实验室制取氯气及氯气与铜的反应。
分析:①装置气密性的检查是在装置连接好后,而尚未放入药品之前进行的。装置气密性的检查中,为使现象明显,可采用酒精灯加热烧瓶的方法,当烧杯中的导管口有气泡冒出时,停止加热,若导管口部形成一段水柱,表明整套装置不漏气。
②B中选用饱和食盐水除去A中产生的  中的杂质气体
中的杂质气体
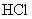 ;C中盛放浓硫酸,除去
;C中盛放浓硫酸,除去  中混有的水蒸气。
中混有的水蒸气。
③D中发生如下反应:
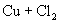

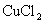
将生成物 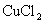 溶解于少量的水中,得到绿色的
溶解于少量的水中,得到绿色的
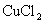 溶液。
溶液。
18解答:①五处错误:
(1)铁架台上应添加点燃的酒精灯;
(2)铁圈上放置石棉网;
(3)稀盐酸改用浓盐酸
(4) 盛浓硫酸和盛饱和食盐水的两只洗气瓶应交换位置;
(5)盛浓 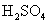 的洗气瓶中的进气导管和出气导管应该为“长进短出”。
的洗气瓶中的进气导管和出气导管应该为“长进短出”。
②在更正后的装置图中,洗气瓶中的饱和食盐水的作用是洗去  中所含的少量
中所含的少量
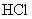 气体;盛放浓硫酸的洗气瓶,可以除去
气体;盛放浓硫酸的洗气瓶,可以除去
 中水蒸气;烧杯中盛放的
中水蒸气;烧杯中盛放的
 溶液可以吸收尾气,发生反应:
溶液可以吸收尾气,发生反应:

21解析:这是一道信息给予题,需要把原有知识和新信息结合起来加以运用,新信息有3个:
(1)漂白粉的成份是:Ca(OH)2. 3CaCl(ClO). nH2O
(2)有效氯= 
(3)漂白粉与过量盐酸反应的方程式应为:
Ca(OH)2. 3CaCl(ClO). nH2O + 8HCl=4CaCl2 + (n+5)H2O + 3Cl2 ↑
455+18n 3×71

所以解出n=8.5
答:n值为8.5。
17 用
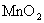 和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水
和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水
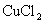 ,装置如下图所示。
,装置如下图所示。
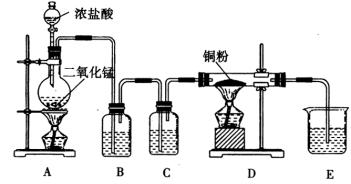
请回答下列问题:
①实验前检查整套装置的气密性的方法是 。
②B中选用的试剂是饱和食盐水,其作用是 ;C中选用的试剂是 ,其作用是 。
③D中反应的化学方程式是 ,将此生成物溶于少量水,得到 色溶液。
18某学生设计如下实验装置用于制备纯净的
 。
。
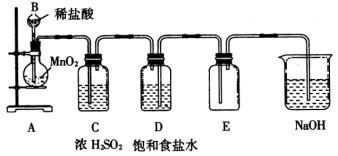
①装置中有五处错误,请指出。
(1) ,
(2) ,
(3) ,
(4) ,
(5) 。
②在更正后的装置图中,洗气瓶(净化气体)中的饱和食盐水、浓硫酸、氢氧化钠溶液的作用分别是:
(1)饱和食盐水的作用 ;
(2)浓硫酸的作用 ;
(3)氢氧化钠的作用 。
19(8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
 KBr+BrCl===KCl+Br2
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式______________。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式____________________________。⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________。
⑶试推测ICl的沸点所处的最小范围______________。
20(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。

请按要求填空:
⑴反应③的化学方程式______________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
16.(2001年全国,17)在100 mL 0.01 mol/L 的AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.01 mol CuSO4•5H2O的溶液,充分的以。下列说法中正确的是
C.最终得到白色沉淀和无色溶液
B 最终得到的白色沉淀是等物质的量的两种化合物的混合物
D. 在最终得到的溶液中,Cl-的物质的量为0.02 mol
D. 在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol/L
15.氯气在70℃的NaOH溶液中,同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO和NaClO3的物质的量之比为4:1 ,则溶液中NaCl和NaClO的物质的量之比为
A.1:1 B.9:4 C.5:1 D.11:2
14.Cl2是有毒的,曾被法西斯制成毒气弹用于侵略战争。当可用的防御办法是这种毒气弹顺风爆炸时,通常
A.人畜应躲到低洼的地方去 B.人畜应到较高的地方去
C. 可用肥皂水或尿液浸湿软布蒙面 D.人畜应多饮水
12.(2001年全国,17)在100 mL 0.01 mol/L 的AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.01 mol CuSO4•5H2O的溶液,充分的以。下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B 最终得到的白色沉淀是等物质的量的两种化合物的混合物
B. 在最终得到的溶液中,Cl-的物质的量为0.02 mol
D. 在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol/L
13室温下,二氧化氯是黄绿色的气体,由氯酸钠和二氧化硫、硫酸反应制得,其水溶液是防治“非典”的首选消毒剂。下列叙述错误的是
A.二氧化氯中氯元素显正价 B.二氧化氯是HClO3的酸酐
C.二氧化氯具有强氧化性 D.等物质的量的二氧化氯的消毒效果比次氯酸好
8.下列物质的变化规律,与共价键的键能有关的是
A. F2、Cl2、Br2、I2的熔、沸点逐渐升高
B HF、HCl、HBr、HI的热稳定性依次减弱
C 金刚石的硬度、熔点、沸点都高于晶体硅
D NaF、NaCl、NaBr、NaI的熔点依次降低
9用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是
A.利用紫外线杀死水中的细菌 B.提高水温,有利于金鱼生长
C.增加水中氧气的含量 D.促使水中的次氯酸分解
10关于氯化氢的甲苯溶液,下列说法中正确的是
A.能导电 B.与干燥的大理石作用时有气体逸出
C.与锌粒作用时能产生氢气 D.通入氨气产生白色沉淀
11室温下,二氧化氯是黄绿色的气体,由氯酸钠和二氧化硫、硫酸反应制得,其水溶液是防治“非典”的首选消毒剂。下列叙述错误的是
A.二氧化氯中氯元素显正价 B.二氧化氯是HClO3的酸酐
C.二氧化氯具有强氧化性 D.等物质的量的二氧化氯的消毒效果比次氯酸好
5.下列方程式正确的是( )
A. 
B. 
C. 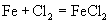
D. 
6实验室用下列两种方法制取氯气:①用含  146g的浓盐酸与足量的
146g的浓盐酸与足量的 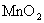 反应;②用87g
反应;②用87g 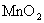 与足量的浓盐酸反应所得氯气是( )
与足量的浓盐酸反应所得氯气是( )
A.①比②多 B.②比①多 C.①、②相等 D.无法比较
4.能与硝酸银反应,生成沉淀的是( )
A. 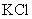 B.
B. 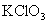 C.
C. 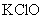 D.
D. 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com