
2、一氧化碳的性质
物理性质: 的气体,有 , 于水。
化学性质:
①CO具有可燃性,其反应方程式为2CO + O2 === 2CO2。


 ②CO具有还原性,它与CuO、Fe2O3、H2O反应的化学方程式分别为
②CO具有还原性,它与CuO、Fe2O3、H2O反应的化学方程式分别为
CO + CuO Cu + CO2,Fe2O3 +3CO 2Fe + 3CO2 ,CO + H2O CO +H2
1、碳的单质
(1)碳有多种同素异形体,重要的有金刚石、石墨和C60等,它们的晶体类型分别是原子晶体、过渡型晶体、分子晶体。
(2)碳的化学性质
|
主要性质 |
具体事实 |
化学方程式 |
|
可燃性 |
①与O2反应 |
   C + O2 (足量)
CO2 ,2C + O2 (不足)
2CO C + O2 (足量)
CO2 ,2C + O2 (不足)
2CO |
|
还原性 |
②与CO2反应 |
C + CO2
2CO |
|
③与CuO反应 |
   C + 2CuO
2Cu + CO2↑,C + CuO Cu + CO↑ C + 2CuO
2Cu + CO2↑,C + CuO Cu + CO↑ |
|
|
④与H2O反应 |
C + H2O CO +H2 |
|
|
⑤与SiO2反应 |
  2C + SiO2 Si + 2CO↑,3C + SiO2 SiC + 2CO↑ |
|
|
⑥与浓硫酸反应 |
 C+2H2SO4(浓) CO2↑+2SO2↑+ 2H2O |
|
|
⑦与浓硝酸反应 |
  C + 4HNO3(浓)
CO2↑ +4NO2↑+ 2H2O C + 4HNO3(浓)
CO2↑ +4NO2↑+ 2H2O |
|
|
弱氧化性 |
与H2作用 |
C
+ 2H2
CH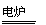 4 4 |
|
歧化反应 |
与氧化钙作用 |
3C + CaO CaC2 + CO↑ |
13.V(H2):V(O2)=16:11或19:8
12. (1)A、B(2)非金属;因为A+B→乙+C,且乙为单质,可知乙元素在A、B中分别显正、负价,所以乙是非金属。(3)S(或N2)H2S(或NH3)
11.(1)2NH3+NaClO=N2H4+NaCl+H2O NaClO N2H4
(2)N2H4(l)+2H2O2(l)=N2(g)+4H2O(l);△H=-817.625KJ/mol (3) D
(4)原子晶体 共价键
10.(1)C+H2O(气)→CO+H2(2)NH4++H2O→NH3·H2O+H+
(3)尿素H4NOOC-COONH4(4)3CuO+2NH3→3Cu+N2+3H2O
9.(1)(NH4)2S O2 H2O(2)H2SO4 (3)HNO3
5.(1)Cl(或氯) K(或钾)
(2)Cl2+2KOH=KCl+KClO+H2O
(3)2KClO3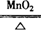 2KCl+3O2↑
2KCl+3O2↑
课后练习:1.B 2.A 3.C 4.C 5.A 6.A 7.C 8.B
4.(1)H2(2)2F2+2H2O==4HF+O2↑
(3)若D为N2,丙、丁分别是NH3和NO,在一定条件下可以反应(NH3、NO中N元素的化合价分别是-3、+2,0价居其中);若D为C,丙、丁分别是CH4与CO2,化合价分别是-4、+4,0价居其中,故理论上也可发生反应生成碳单质。
13.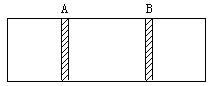 如图所示,在一密闭容器中间用一不漏气, 可滑动的活塞隔开,左边充洁净空气,右边充H2、O2混合气,在室温下引燃后恢复到原室温,若活塞原来离容器左端的距离为1/4(A)反应后活塞静止在离右端1/4处(B),求原来H2和O2的体积比。
如图所示,在一密闭容器中间用一不漏气, 可滑动的活塞隔开,左边充洁净空气,右边充H2、O2混合气,在室温下引燃后恢复到原室温,若活塞原来离容器左端的距离为1/4(A)反应后活塞静止在离右端1/4处(B),求原来H2和O2的体积比。
典例解析
[例1]Ge:第Ⅳ主族元素,最高正价+4;最高价氧化物GeO2。
Bi:第Ⅴ主族元素,最外层5个电子→满足8电子稳定结构应形成共价键数目:8-5=3→BiCl3→在BGO中铋为+3价→氧化物Bi2O3。
设BGO化学式为mGeO2·nBi2O3,则有:2m=3n m∶n=3∶2 m=3 n=2
故BGO化学式为3GeO2·2Bi2O3 (或Bi4(GeO4)3)
[例2]短周期元素中室温下常见的非金属单质中为气体的有H2、N2、O2、F2、Cl2 ,常见的固体单质有C、P、Si ,这些单质中式量最小的可能是H2。由图中转化关系可知,A+C→X,B+C→甲,A+D→Y,B+D→丙,X+甲→乙均为化合反应;Y+甲→丙+乙为复分解反应。5个化合反应中,A+D→Y的反应,涉及D物质必须“过量”,即若“不过量”,会生成其他物质。结合上述几种单质间能发生的反应,只有磷与Cl2或碳与O2才有可能,但当固体单质是碳时,其他转化关系不成立。再结合非金属卤化物易水解的性质,推测Y是PCl5,甲是水,则丙是HCl,乙为磷酸,D为Cl2,C为O2,A为磷,X为P2O5。
答案:(1)H3PO4 (2)2种(化合与复分解),5(3)O(O2与O3)、P(红磷与白磷)
[例3] ①Na2SO4、Na2CO3、Na2SiO3、Na2SO3
②取少量该溶液加入试管中,向其中加入稀盐酸。如果出现白色沉淀,则原溶液是Na2SiO3溶液;若产生无色、无味的气体,则原溶液是Na2CO3溶液;若产生无色、有刺激性气味的气体,则原溶液是Na2SO3溶液;若无明显现象出现,则说明为Na2SO4溶液。(本题为开放题,若有其它推测,且检验方案正确,均给分)
当堂反馈:1.C 2.A 3. C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com