
3.纯净的碳酸氢钙试样在高温下,当剩余的固体质量为原试样质量的一半时,碳酸氢钙的分解率为
A.50% B.75% C.92.7% D.100
2.(2002年全国,23)用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A.FeO B.Fe2O3 C.CuO D.Cu2O
1.下列物质中,既能与某些金属和非金属反应,又能与某些金属氧化物和非金属氧化物反应的是
A.CO2 B.Al2O3 C.CuSO4 D.H2O
4.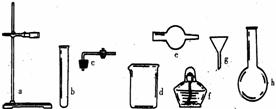 (1)在没有现成的 CO2气体发生器的情况下,请你选用右图中的部分仪器,装配成一个简易的,能随开随用,随关随停的 CO2气体发生装置。应选用的仪器是(填入仪器的编号)_________。
(1)在没有现成的 CO2气体发生器的情况下,请你选用右图中的部分仪器,装配成一个简易的,能随开随用,随关随停的 CO2气体发生装置。应选用的仪器是(填入仪器的编号)_________。
A.abcd B.degh C.bcd D.acde
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状石灰石,比较合理的方案中应选用的药品是____________________。
第41讲 碳以及重要的化合物
3. (2005年上海,21)碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
(2005年上海,21)碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
A.气瓶中产生的沉淀是碳酸钡
B.Z导管出来的气体中无二氧化碳
C.气瓶中产生的沉淀是硫酸钡
D.Z导管口有红棕色气体出现
2.(2001年广东,10)为制备干燥、纯净的CO2气体,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入
A.水;无水CaCl2固体 B.饱和NaHCO3溶液;浓H2SO4
C.浓H2SO4;饱和Na2CO3溶液 D.饱和Na2CO3溶液;稀H2SO4
1.(2000 年全国,9)向下列溶液中通入过量CO2,最终出现浑浊的是
A.氢氧化钙饱和溶液 B.碳酸钠饱和溶液
C.硅酸钠溶液 D.氯化钙饱和溶液
[例1](2000年全国春季高考,12)某无色混合气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下连续处理(假定每步处理均反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清的石灰水时,溶液变得浑浊。由此可以确定原混合气体中D
A.一定含有CO2、H2O,至少含有H2、CO中的一种
B.一定含有H2O、CO,至少含有CO2、H2中的一种
C.一定含有CO、CO2,至少含有H2O、H2中的一种
D.一定含有CO、H2,至少含有H2O、CO2中的一种
[例2](2002年上海,15)将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是

A B C D
4、碳酸盐性质规律
(1)溶解性规律:如果碳酸的正盐溶解度较大,则酸式盐的溶解度较小[如:Na2CO3> NaHCO3;如果碳酸的正盐溶解度较小,则酸式盐的溶解度较大[如:CaCO3< Ca(HCO3)2。
(2)稳定性:难溶性的碳酸盐,(NH4)2CO3及酸式盐受热易分解;可溶性的碳酸盐较稳定,受热难分解。
(3)酸式盐与碱反应时的产物要根据相对用量判断,如:在Ca(HCO3)2溶液中滴加NaOH溶液:Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2O (NaOH少量)
Ca(HCO3)2+2NaOH=CaCO3↓+ Na2CO3+2H2O (NaOH过量)
(4)CO32-和HCO3-的检验:利用正盐和酸式盐的溶解性可区别CO32-和HCO3-,如用BaCl2溶液。利用与H+反应产生CO2的方法,检验CO32-或HCO3-。
3、二氧化碳的性质
物理性质: ,密度比空气大的气体, 于水,固体CO2叫做“ ”。
化学性质:
|
主要性质 |
具体事实 |
化学方程式 |
|
酸性氧化物的通性 |
①与水作用 |
CO2 + H2O  H2CO3 H2CO3 |
|
②与碱作用 |
CO2 +Ca (OH)2==CaCO3↓+ H2O |
|
|
③与碱性氧化物作用 |
CO2 +CaO==CaCO3
|
|
|
④与某些盐作用 |
Na2SiO3 + CO2
+ H2O = Na2CO3+H2SiO3↓ |
|
|
弱氧化性 |
⑤与镁作用、与碳作用 |
2Mg + CO2 2Mg+ C |
|
其它 |
⑥与过氧化钠作用 |
2Na2O2 + 2CO2
= 2Na2CO3 + O2 |
制法
工业制法:
CaCO3===
实验制法:石灰石和稀盐酸反应
CaCO3+2HCl===
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com