
典型例题
|
|


 不变色 血红色溶液
不变色 血红色溶液
|
|

 未知溶液
火焰呈浅紫色
未知溶液
火焰呈浅紫色

|


|


 |
|||||||
|
|||||||
 |
|||||||
 |
|||||||
|

由以上实验事实,请回答:
(1)未知溶液中肯定存在的离子有________________
(2)SO42-、SO32-能否肯定其存在_____(填“能”或“不能”)理由是__________
(3)判断Fe2+、Fe3+是否存在的依据是___________
(4)写出生成D的离子方程式____________
解析 焰色反应实验可肯定K+存在;与KSCN溶液混合不变色,但加入溴水却出现血红色,这说明Fe2+存在而Fe3+不存在;滤液加AgNO3和HNO3.出现白色沉淀B,且过滤以前又未加过Cl-,这证明未知溶液中含有Cl-;根据沉淀D的生成及其转变,可推知溶液中有Al3+.
又白色沉淀A为BaSO4,因为HNO3的氧化性.可将SO32-氧化成SO42-,似乎不能确定原样品存在的是SO32-还是SO42-.但是SO32-与Fe2+、Al3+不能共存在,所以仍应肯定原样品存在SO42-.
生成D的离子方程式为:AlO2-+H++H2O=Al(OH)3↓
例2 某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( A、C )
A. NH4+ B. Mg2+ C. Fe2+ D. Al3+
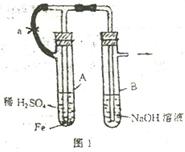
例3 根据下述实验装置和操作,回答有关问题.
(1)按图1中所示装置,用两种不同操作分别进行实
验,观察B管中现象.
操作1 先夹紧止水夹a,再使A管开始反应.实验中
在B管中观察到的现象是_________________
____________________________.B管中发生的
反应的离子方程式是:
操作2 打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a.实验中在B管中
观察到的现象是_____________________________.
B管中发生的反应的离子方程式是:_____________________.
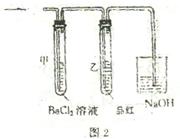 (2)上述装置的实验结束后,取A管内反应所得溶液,
(2)上述装置的实验结束后,取A管内反应所得溶液,
隔绝空气小心蒸干后再高温煅烧(有关装置及操作
均已略去),最后留下红色固体.将分解时产生的气
体按图2所示装置依次通过洗气装置,结果试管甲
内出现白色沉淀,试管乙内溶液红色褪去.回答:
问题1 用化学方程式说明试管甲产生白色沉淀的原因(不用文字说明).
问题2 根据实验现象,写出图1中A管内溶液蒸干后,在高温煅烧分解时所发生的
氧化还原反应的化学方程式.
解析 (1)操作1 因夹紧a,使Fe与H2SO4反应产生的H2无法进入B.A容器中液面上压强增大,可将A中反应后溶液压入B中,当NaOH足量时,Fe2+与OH-反应产生白色沉淀,迅速变成灰绿色,最后变成红褐色.
Fe2++2OH-=Fe(OH)2↓, 4Fe(OH)2+O2+2H2O=4Fe(OH)3
操作2 先打开a反应一段时间,使反应产生的H2能导入B中,H2不溶于NaOH溶液,并能驱赶其中的空气,故可看到B中有气泡冒出.当再夹紧a后,又可观察到A中的溶液压入到B中,但生成的白色沉淀较长一段时间不变色.
Fe2++2OH-=Fe(OH)2↓
|
 问题2 2FeSO4 Fe2O3+SO2↑+SO3↑
问题2 2FeSO4 Fe2O3+SO2↑+SO3↑
(红)
想一想 将一小粒Na投入到盛有FeCl2溶液的烧杯中,能观察到什么现象?
|
|
Fe2+ |
Fe3+ |
|
溶液的颜色 |
|
|
|
加碱溶液 |
|
|
|
加KSCN溶液 |
|
|
(1)特殊的颜色:Fe3+在无水时呈淡紫色,在水溶液中以[Fe (H2O)6]3+形式存在而呈黄色,在结晶水合物中如FeCl3•6H2O,也以[Fe (H2O)6]3+形式存在而使晶体呈棕褐色。
(2)水解性:①Fe3+水解能力强。在常温下,Fe3+ + 3H2O Fe(OH)3
+3H+ ,
Fe(OH)3
+3H+ ,
在沸水中:Fe3+ + 3H2O(沸水)== Fe(OH)3 (胶体)+3H+
②当Fe3+遇到HCO3-、CO32-、AlO2-等离子时,彻底水解(双水解)。
③将FeCl3溶液蒸发、灼烧后得Fe2O3,原因是:加热后水解平衡FeCl3+ 3H2O Fe(OH)3
+3HCl向正反应方向移动,HCl挥发使水解完全,得到Fe(OH)3,灼烧后又发生反应:2Fe(OH)3 == 2Fe2O3+3H2O,故得Fe2O3。
Fe(OH)3
+3HCl向正反应方向移动,HCl挥发使水解完全,得到Fe(OH)3,灼烧后又发生反应:2Fe(OH)3 == 2Fe2O3+3H2O,故得Fe2O3。
(3)较强的氧化性
Fe3+的氧化性在金属阳离子中是比较强的,氧化性:Ag+> Fe3+> H+>Cu2+;Br2> Fe3+> I2
(4)络合反应:Fe3++SCN-=[Fe (SCN)]2+ ,血红色溶液
Fe3+ + 6C6H5OH==[Fe (C6H5O)6]3-]+6H+ ,显紫色。
|
氢氧化物 |
氢氧化亚铁 |
氢氧化铁 |
|
化学式 |
|
|
|
物理性质 |
|
|
|
化学性质 |
|
|
|
制法 |
|
|
|
化学式 |
FeO |
Fe2O3 |
Fe3O4 |
|
俗名 |
-- |
|
|
|
色态 |
|
|
|
|
价态 |
|
|
|
|
与H+反应 |
|
|
|
|
与CO反应 |
|
(1)写出铁与与非金属反应的化学方程式
① 2Fe + 3Cl2 -
② Fe + O2-
③ Fe + S-
④ Fe + I2 -
(2)铁与水的反应
(3)铁与酸的反应
①铁与非氧化性酸的反应(离子方程式)
②铁与氧化性酸的反应
在常温下铁遇到浓硫酸或稀硝酸发生 ,加热时发生剧烈反应。
(4)铁与盐溶液的反应
(5)铁与FeCl3溶液的反应
铁是一种常见的金属元素,在地壳中的含量居第 位,位于元素周期表的第 周期第 族,通常有 种化合价,且 比 价稳定。
14.化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸和硝酸银,产生白色沉淀 ;
②加入氯化钡溶液,无沉淀生成;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀;
(1)由此判断组成该化合物的元素中,可能存在的卤素有 ,A与水反应后生成的溶液中含有的离子可能有 。
(2)要确定该化合物的分子式,称取11.90g A溶于水稀释至250.0mL,取25.00mL溶液加入足量的高锰酸钾溶液和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重,为2.33g,试确定A的化学式,写出计算过程。
13.H2燃烧时除生成水外,还可生成少量的H2O2,但一般条件下很难得到H2O2。如果将H2燃烧时产生的火焰用冰块冷却,就可检验出极少量的H2O2生成。实验前,用两只蒸发皿盛好冰(用蒸馏水冷凝而成),做对比实验如下:
Ⅰ:一只蒸发皿放在石棉网上加热,使冰块慢慢熔化成液体,再加入0.1 mol/L碘化钾淀粉溶液,不显蓝色。
Ⅱ:另一只蒸发皿用调节好的氢气火焰对着冰块加热,熔化成液体后,再加入0.1 mol/L碘化钾淀粉溶液,立即变成蓝色。
⑴一般条件下得不到H2O2的原因是:__________________________________________;
⑵要做对比实验的理由是:________________________________________________ ;
⑶为了增强实验效果,且能迅速检验出反应过程中生成H2O2,在不另加任何试剂和用品的情况下,你认为如何改?______________________________________________ ;
⑷能否________(填“能”或“不能”)将实验Ⅱ中的0.1 mol/L碘化钾淀粉溶液换成酚酞试剂;理由是_________________________________________________。
12.氧元素的同素异形体有_____和臭氧。现采用下法测定臭氧的化学式:取O2和Om的混合气体,从其中取出体积相同的两份气体。往1份气体中加松节油,Om完全被吸收,结果气体体积减少了V mL;加热另一份气体,使其中Om全部分解成O2,则气体体积增加V/2mL(体积都是在同温同压下测定),则m值为______。臭氧是一种氧化性比氧气更强的氧化剂,例如,臭氧通入到碘化钾溶液中有一种无色气体逸出,所得溶液可使酚酞变红,也可使淀粉变蓝,由此判断,发生反应的化学方程式是___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com