
4.电解质、非电解质,强电解质、弱电解质
|
物质类别 |
电 解 质 |
非电解质 |
||
|
强电解质 |
弱电解质 |
|||
|
相 同 点 |
均 为 化 合 物 |
|||
|
不 同 点 |
化学键类型 |
离子键、共价键 |
共 价 键 |
共 价 键 |
|
电离程度 |
完全电离 |
部分电离 |
不 电 离 |
|
|
电离过程 |
不 可 逆 |
可 逆 |
―――― |
|
|
电离方程式 |
用“=” |
用“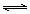 ” ” |
―――― |
|
|
水溶液中的粒子 |
水合离子 |
水合分子、水合离子 |
水合分子 |
|
|
物质类别 |
强酸、强碱、 大多数盐 |
弱酸、弱碱、水 |
非金属氧化物、大多数有机物、NH3等 |
|
|
实 例 |
|
|
|
3.离子反应的条件:离子反应总是向某些离子浓度减小的方向进行。对于离子互换反应,其表现是有难溶性物质生成或弱电解质生成或挥发性物质生成;对于氧化还原反其表现为生成氧化性或还原性更弱的物质以降低有关离子的浓度。
2.离子反应的本质:反应混合液中离子或离子浓度发生变化。
1.离子反应:由离子参加或生成的反应。
15.(2005江苏)(12)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水2-3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广囗瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是__________________,加热的作用是____________________。
(2)实验步骤②明显不合理,理由是_______________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_____________;_______________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
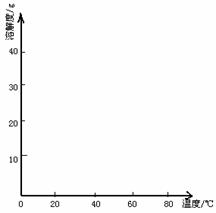
⑤若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为__________。
14.现有CuCl2和FeCl2的混合液400mL,测定其中[Cl-]=a mol/L,投入过量的锌粉bg,充分反应后过滤,所得残渣固体洗涤干燥后,质量为cg.
(1)原混合溶液中[Fe2+]=_________, [Cu2+]=_________
(2)b的数值范围是______________
(3)c的数值越大,说明混合液中CuCl2的含量越_______,C的最大值为_______.
13.A、B、C是中学化学中常见的单质,常温下甲、乙两种化合物分别是黑色固体和无色液体,这些化合物和单质间有右下图所示的关系.据此判断:
(1)元素A有可变化合价,则单质A是______,化合物甲是________.
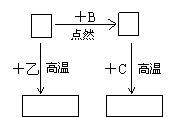
 (2)高温下① 甲+C A+乙
(2)高温下① 甲+C A+乙
 ② A+乙 甲+C
A
甲
② A+乙 甲+C
A
甲
欲使反应②顺利进行,应采取的
措施是______________
(3)甲还能与另一种常见金属在一定
温度下反应,并放出大量热,其化 甲+C A+乙
学方程式为__________________
12.将7g铁粉与100mL 4mol/L稀HNO3反应,放出NO气体,反应后溶液中所存在的离子浓度由大到小的顺序为_____________________________.
11.某硝酸与过量铁粉反应,共生成4.48L(S、T、P)N2O气体。如改与铝粉反应(生成NO气体),最多可溶解铝______g.
10.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S、T、P)的气体.所得溶液中,加入KSCN溶液无血红色出现,
若用足量的CO在高温下还原相同质量的此混合物,能得到的铁的质量为( )
A. 11.2g B. 5.6g C. 2.8g D. 无法计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com