
3.影响化学反应速率的因素以及微观解释
|
影响因素 |
规
律 |
注 意 点 |
|
|
内 因 |
反应物的结构、性质、反应的历程是决定化学反应速率的主要因素 |
化学反应的实质是旧化学键的断裂,新化学键的生成。若在同样的条件下,反应物分子中化学键越牢固,化学键的断裂就越难,其反应速率就越小 |
|
|
外 因 |
浓 度 |
在其他条件不变时,增大反应物浓度,单位体积内 也相应增大,反应速率
。反之,反应速率减慢。 |
固体物质的浓度恒定,故改变固体物质的用量对反应速率无影响。固体物质对速率的影响只与其表面积的大小和生成物在表面的扩散速率有关。 |
|
压 强 |
在其他条件不变时,对于有气体参加的反应,增大压强,气体的体积减小,浓度增大, 也相应增大,反应速率加快。反之,反应速率减慢。 |
由于压强对固体,液体的体积几乎无影响,因此对于无气体参加的反应,压强对反应速率的影响可忽略不计;恒容时,若充入与平衡体系无关的气体虽总压增大,但各反应物浓度不变,反应速率不变。 |
|
|
温 度 |
在其他条件不变时,升高温度,反应物分子能量增加,从而增大了
,有效碰撞次数增多,反应速率加快。反之,反应速率减慢。 |
一般来说,温度每升高10ºC,反应速率增大到原来2-4倍;对于有催化剂参加的反应,要注意催化剂的活性温度。 |
|
|
催 化 剂 |
在其他条件不变时,使用正催化剂能降低
,增大
百分数,反应速率显著增大。 |
若使用负催化剂,反应速率明显减慢,一般无特殊说明指正催化剂;催化剂具有选择性,反应前后质量与组成保持不变。 |
|
|
其 他 |
光、超声波、紫外线、固体颗粒大小、溶剂等对化学反应速率也有影响。 |
附:外因对化学反应速率影响的微观解释
|
影响因素 |
分子总数 |
活化分子百分数 |
活化分子数 |
单位体积活化分子数 |
|
增大浓度 |
|
|
|
|
|
增大压强 |
|
|
|
|
|
升高温度 |
|
|
|
|
|
正催化剂 |
|
|
|
|
注意:化学反应速率的大小是由单位体积内活化分子数(相当于活化分子浓度)决定的,而不是由活化分子数的多少决定的。
2.化学反应速率通常指在某一时间内的 ,而不是某时刻的 。在具体反应中各时刻的反应速率是不相等的。一般不用 或 来表示化学反应速率。而且无论以反应物浓度的减少还是生成物浓度的增加来表示化学反应速率,都不取负值。
1.化学反应速率(v)的含义 、
基本计算公式 、
单位 、
同一化学反应中各物质化学反应速率之间的关系 。
10.将铜、铁、锌三种金属(按等质量混合)的混合物W克,加入FeCl3和盐酸的混合液中,充分反应后,关于Fe3+、H+、Fe2+、Zn2+、Cu2+是否共存于溶液中,讨论如下:
(1) 若无固体剩余,则溶液中一定有Fe2+、Zn2+、Cu2+、H+,可能还有Fe3+。
(2)若剩余固体粉末为W/3克,则溶液中一定有Fe2+、Zn2+,可能还有H+,一定没有Fe3+
Cu2+。
(3)若未反应的固体粉末为3W/4克,则溶液中一定有Zn2+,一定没有Fe3+、H+、Fe2+、Cu2+。
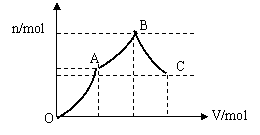
9、向100mL 3mol·L-1硫酸铝铵[(NH4)Al(SO4)2]溶液中逐滴加入1mol·L-1Ba(OH)2溶液。
⑴写出当刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示):
Al3++2SO42-+NH4++2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O;
⑵随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图表示。写出B点和C点所对应的Ba(OH)2溶液的体积:B600ml,C750ml。
8、NaBH4作为还原剂,在有机化学中有极为广泛的用途。
⑴NaBH4极易溶于水并与水作用产生H2,反应后硼元素以BO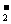 形式存在于溶液中,此反应的离子方程式为: BH
形式存在于溶液中,此反应的离子方程式为: BH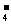 +2H2O=BO
+2H2O=BO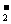 +4H2↑。
+4H2↑。
⑵该反应与溶液酸碱度有关,pH越小,反应速率越快,其原因是_因为NaBH4与水反应的实质是OH-与H+反应,pH值越小,反应速率越大。
⑶NaBH4可使许多金属离子还原为金属单质。例如它可以使含有金离子(Au3+)的废液中的Au3+还原(碱性条件,此时硼仍以BO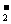 形式存在),离子方程式为8Au3++3BH
形式存在),离子方程式为8Au3++3BH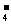 +24OH-=3BO
+24OH-=3BO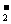 +8Au+18H2O。
+8Au+18H2O。
7、某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Fe3+、Ba2+、Al3+、
AlO2-、S2-、SO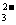 、SO
、SO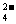 ,现取该溶液进行有关实验,实验结如下:
,现取该溶液进行有关实验,实验结如下:
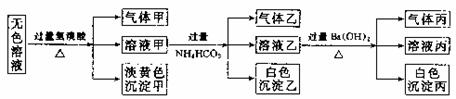 (1)沉淀甲是
S (填化学式), 生成沉淀甲的离子方程式为 2S2-+SO
(1)沉淀甲是
S (填化学式), 生成沉淀甲的离子方程式为 2S2-+SO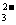 +6H+
+6H+ 3S↓+3H2O
;
(2)沉淀乙是Al(OH)3(填化学式),由溶液甲生成沉淀乙的离子方程式为 Al3++3HCO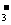
Al(OH)3↓+3CO2↑;
(3)沉淀丙可能是BaCO3或BaCO3和BaSO4 (填化学式)。
(4)气体甲的成分有哪几种可能,答:① H2S ②SO2 ③ ;
(有多少种就填多少种,可不填满。)
(5)综合上述信息,可以肯定存在的离子有S2- SO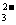 AlO
AlO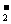 Na+ 。
Na+ 。
6.工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3-4时,Fe3+以Fe(OH)3的形式完全沉淀。
⑴ 为除去溶液中Fe2+,可采用的方法是 。
⑵ 工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液的pH变化是 。
⑶ 若此溶液只含Fe3+时,要调整pH在3-4之间,此时最好向溶液中加入 。
⑷ 已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
5.某无色溶液中存在SiO32-,若向其中加入NH4Cl溶液后产生白色沉淀,若向其中加入CaCl2溶液也产生白色沉淀,则下列各组离子能在该溶液中共存的是
A、F-、C17H35COO-、Na+、NO3- B、AlO2- 、NH4+、ClO-、CO32-
C、CO32-、NH4+、Ag+、MnO4- D、Na2+、Ca2+、C2O42-、Cl-
4.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是
A.Na+、Ba2+、Cl-、SO42- B.H+、NH4+、Al3+、SO42-
C.H+、Fe2+、NO3-、Cu2+ D.K+、AlO2-、CH3COO-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com