
3.判断离子能否大量共存
一般来说,水解情况相反的离子(一种水解显酸性,一种水解显碱性)在溶液中不能大量共存 。
2.比较盐溶液中离子种类的多少?
例:将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是( )
A.KCl B.Mg(OH)2 C.Na2CO3 D.MgSO4
1.判断盐溶液的酸碱性及其强弱
思考:如何比较等物质的量浓度的各种盐溶液的pH大小?例如HCOONa、CH3COONa、Na2CO3
思考:相同条件下,测得①NaHCO3,②CH3COONa,③NaAlO2三种稀溶液的pH值相同,那么,它们的物质的量浓度由大到小的顺序为
18.现有MgSO4和Al2(SO4)3的混合物溶于水配成100mL溶液,向其中加入足量的BaCl2溶液过滤、烘干,称量沉淀为69.9g,若原混合液中Al3+有物质的量与溶液中离子的总物质的量之比为a(不考虑水解、水的电离)。
(1)原混合溶液中c(SO42-)=
(2)a的取值范围为 。
(3)若Al3+的物质的量为xmol,则x= (用含a的代数式表示)
(4)向滤液中加入过量的NaOH溶液,过滤,灼烧沉淀,最后得固体6g,则a为 。
第十九讲 盐类水解及其运用(第二课时)
[要点精讲]
17.弱酸的相对强弱可以用电离常数(K)表示。以HF为例,其电离常数的计算方法是:K=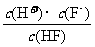 [c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,
[c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,
弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:
⑴ 常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数Kh= ,c(OH-)= ;
⑵ 有理论认为在NaHCO3溶液中存在如下平衡:HCO3-+HCO3-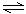 H2CO3+CO32-,该平衡的实质是
;
H2CO3+CO32-,该平衡的实质是
;
⑶ 常温下0.1mol/L的Na2CO3溶液和0.1mol/L的NaHCO3溶液的pH分别为11.6和8.31,饱和H2CO3溶液的pH为3.9。如果用标准HCl溶液滴定Na2CO3、NaHCO3混合溶液而分别测定Na2CO3、NaHCO3的浓度,则应选用的指示剂依次为 。
16.某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A====H++HA- HA- H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显________(填“酸性、中性或碱性”),理由是(用离子方程式表示)
______________________________。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能是________0.11 mol·L-1 (填“>”“=”“<”=。
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是_________________。
15.pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
(1)写出正盐的化学式:_________。
(2)若该盐中只有一种离子水解,该离子水解的离子方程式为_________。
(3)简述该混合液呈碱性的原因。
14.HgF2有强烈的水解性,即使在2mol/L HF中水解度也高达80%,生成HgO和HF;HgCl2溶于水,只发生极弱的水解作用,25℃0.0078mol/L HgCl2的水解度为1.4%;HgBr2水解作用更弱,0.009mol/L HgBr2的水解度为0.08%.HgF2的水解性明显强于HgCl2和HgBr2的水解性,原因是__ _____.
13.在6份0.01mol/L氨水中分别加入下列各物质:
A.浓氨水 B.纯水 C.少量K2CO3
D.少量浓H2SO4 E.少量NaOH固体 F.少量Al2(SO4)3固体
(1)能使[OH-]减小、[NH4+]增大的是___________
(2)能使[OH-]增大、[NH4+]减小的是____________
(3)能使[OH-]和[NH4+]都增大的是______________
(4)能使[OH-]和[NH4+]都减小的是______________
12.常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
A.甲中水电离出来的H+浓度是乙中水电离出来的H+浓度的1/10
B.物质的量浓度c(甲)>10c(乙)
C.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>10V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com