

3.影响电离平衡的因素:弱电解质电离平衡的移动遵循勒沙特列原理。
① 浓度:稀释能 弱电解质的电离(但溶液的导电能力不一定增大);
② 温度:电离过程是一个 热的过程,故升高温度能 弱电解质的电离;
③ 其他电解质:以 0.1 mol /L的CH3COOH溶液为例
|
改变条件 |
加水 |
升温 |
加NaOH |
加HCl溶液 |
加CH3COONa固体 |
|
平衡移动 |
|
|
|
|
|
|
n(H+) |
|
|
|
|
|
|
c(H+) |
|
|
|
|
|
|
导电能力 |
|
|
|
|
|
[典型例题]
[例1]下列物质的水溶液能导电,但属于非电解质的是
A.CH3CH2COOH B.Cl2 C.NH4NO3 D.SO2
[例2]在平衡体系:H2CO3 H++HCO3-,HCO3-
H++HCO3-,HCO3- CO32-+H+中,若溶液的pH增大时,c(CO32-)将
CO32-+H+中,若溶液的pH增大时,c(CO32-)将
A.增大 B.减少 C.不变 D.增大或减少
提示:采取什么方法使溶液的pH增大,如加碱或加水稀释等。
[例3]用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
⑴ 在两个方案的第①步中,都要用到的定量仪器是 ;
⑵ 甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分);
① 装HCl溶液的试管中放出H2的速率快;②装HA溶液的试管中放出H2的速率快;
③ 两个试管中产生气体速率一样快。
⑶ 请你评价:乙方案中难以实现之处和不妥之处: ;
⑷ 请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
[当堂反馈]
2.电离平衡:一定条件下(如温度、浓度)下的 溶液中, 速率等于 速率时,电离就达到了平衡状态-电离平衡。电离平衡具有化学平衡的特征。
1.电解质与非电解质
⑴ 强电解质、弱电解质、非电解质的比较
|
类 别 |
电解质 |
非电解质 |
|
|
强电解质 |
弱电解质 |
||
|
电 离 特 点 |
溶于水 电离, 可逆, 不存在电离平衡 |
溶于水 电离,可逆,存在电离平衡 |
熔融状态或水溶液 不能直接电离 |
|
溶质粒 子种类 |
|
|
|
|
化合物 类 别 |
|
|
|
|
电 离 方程式 |
|
|
|
⑵ 电解质、非电解质的判断及溶液的导电性
① 单质和混合物既 电解质,也 非电解质;
② 、 等溶于水后形成的溶液能导电,但本身是非电解质;
③ 水溶液不导电或导电能力弱的化合物,不一定是非电解质或弱电解质;
④ 电解质溶液的导电能力取决于溶液中 的大小。
10.(03上海)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭 g。
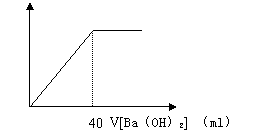
9.用0.05 mol/l的Ba(OH)2溶液,滴定20 ml盐酸和硫酸的混合溶液,图A图B分别是Ba(OH)2加入体积(ml)与溶液PH值和沉淀量的关系,求混合酸中H+、SO42-和Cl-的物质的量浓度各是多少?

8.在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图6-13表示加入的混合物质量与产生的气体体积(标准状况)的关系。
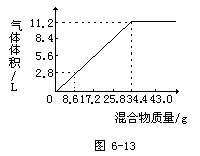 试计算:
试计算:
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标准状况)为______L。
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标准状况)为______L。
7.为测AlCl3溶液的物质的量浓度,某学生把AlCl3溶液滴入到20ml0.3 mol/lNaOH溶液中,滴入AlCl3溶液的体积与生成沉淀的质量关系如图所示,则AlCl3溶液的物质的量浓度为多少,A点值为多少?
6.(2005江苏)(10分)水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO3的水所形成的水垢的化学组成,取干燥的水垢6.32 g ,加热使其失去结晶水,得到5.78 g 剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到的11.82 g 沉淀。
(1)通过计算确定A中是否含有碳酸镁;
(2)5.78 g 剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82 g ,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐质量分数。
5.(2005广东)(12分)钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的
白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿矿储量居世界首位。含有Fe2O3的钛
铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
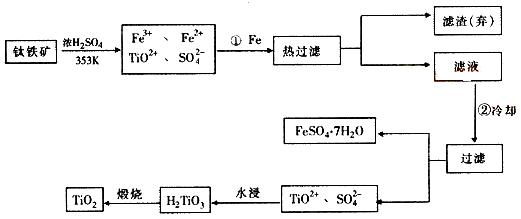
⑴ Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
⑵ 步骤①加铁的目的是____________________________________________________;
步骤②冷却的目的是____________________________________________________。
⑶ 上述制备TiO2的过程中,可以利用的副产物是___________;考虑成本和废物综合利用因素,废液中应加入_________________处理。
⑷ 由金红石(TiO2)制取单质Ti,涉及到的步骤为:
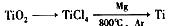
已知:① C(s) + O2(g) == CO2(g); △H = -393.5 KJ/mol
② 2CO(g) + O2(g) == 2CO2(g); △H = -566 KJ/mol
③ TiO2(s) + 2Cl2(g) == TiCl4(s) + O2(g); △H = +141 KJ/mol
则TiO2(s) + 2Cl2(g) + 2C(s)== TiCl4(s) + 2CO(g) 的△H = _________________。
反应TiCl4 + 2Mg == 2MgCl2 + Ti 在Ar气氛中进行的理由是________________________。
4.(2005江苏)某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的是离子组是
A、K+、Na+、HCO3-、NO3- B、Na+、SO42-、Cl-、ClO-
C、H+、Mg2+、SO42-、NO3- D、Ag+、K+、NO3-、Na+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com