
5.常温下,水电离出的c(H+)=1×10-5 mol·L-1的溶液可能是
A.pH=5的NH4Cl溶液 B.pH=9的NaHCO3溶液
C.pH=5的盐酸溶液 D.pH=9的NH3·H2O溶液
4.常温下,浓度为0.1mol·L-1一元酸HA溶液的pH=2.0,浓度为0.1mol·L-1一元碱BOH溶液中c(H+)/c(OH-)=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)>c(A-)>c(OH-)>c(H+)
C.c(B+)>c(A-)>c(H+)>c(OH-) D.c(B+)=c(A-)>c(H+)=c(OH-)
3.下列说法正确的是
A.所有的非金属氧化物都是酸性氧化物 B.BaSO4难溶于水,是弱电解质
C.福尔马林、盐酸、明矾、纯碱都是混合物 D.氨水能导电,但NH3是非电解质
2.相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
1.下列物质中,溶于水形成的溶液能导电但本身不是电解质的是(不考虑水的电离)
① Na,② HF,③ P2O5,④ K2O,⑤ 酒精,⑥ NH3,⑦ BaCO3,⑧ Cl2
A.②⑤⑥⑦ B.③④⑤⑧ C.①③⑥⑧ D.①③④⑧
5.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A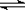 H++HA-, HA-
H++HA-, HA-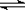 H++A2-。已知相同浓度时的电离程度H2A>HA-,设有下列四种溶液:
A.0.01mol/L的H2A溶液;B.0.01mol/L的NaHA溶液;C.0.01mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液;D.0.02mol/L的NaOH与0.02 mol/L的NaHA溶液等体积混合液。据此,填写下列空白(填代号)
⑴ c(H+)最大的是
,最小的是
;
⑵ c(H2A)最大的是
,最小的是
;
⑶ c(A2-)最大的是
,最小的是
。
H++A2-。已知相同浓度时的电离程度H2A>HA-,设有下列四种溶液:
A.0.01mol/L的H2A溶液;B.0.01mol/L的NaHA溶液;C.0.01mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液;D.0.02mol/L的NaOH与0.02 mol/L的NaHA溶液等体积混合液。据此,填写下列空白(填代号)
⑴ c(H+)最大的是
,最小的是
;
⑵ c(H2A)最大的是
,最小的是
;
⑶ c(A2-)最大的是
,最小的是
。
[课后作业]
4.NH3·H2O的电离方程式为NH3·H2O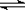 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______。(填序号)
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______。(填序号)

3.为减缓锌(过量)和盐酸的反应速率而又不影响生成氢气的总量,可采用的措施
①加NaOH固体 ②加硫酸 ③加水 ④加固体醋酸钠 ⑤加MgO ⑥加碳酸钾
A.③④⑤ B.③④ C.②③④ D.④⑥
2.短周期元素形成的难电离物质中,前者加酸和加碱都能抑制其电离、后者加酸和加碱都能促进其电离的是
A.水 醋酸 B.醋酸 一水合氨 C.水 氢氧化铝 D.一水合氨 苯酚
1.下列物质按照纯净物、混合物、强弱电解质和非电解质顺序排列的是
A.纯盐酸、水煤气、硫酸、醋酸、干冰
B.冰醋酸、福尔马林、硫酸钡、氢氟酸、乙醇
C.单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫
D.胆矾、漂白粉、氯化钾、次氯酸、氯气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com