
15.用“>”、“<”或“=”填写下列空白。用0.2mol·L-1HA溶液与0.2mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A一),则
⑴ 混合溶液中c(HA) c(A-);⑵ 混合溶液中c(HA)+c(A-) 0. 1 mol·L一1;
⑶ 混合溶液中,由水电离出c(OH-) 0.2mol·L-1HA溶液由水电离出的c(H+ );
⑷ 25℃时,如果取0.2mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度 NaA的水解程度。
14.常温下,0.1mol·L-1亚硝酸(HNO2)溶液的pH约为2。回答下列问题:
⑴ 将1L 0.1mol·L-1的亚硝酸加水稀释为10L,稀释后溶液pH的取值范围是 ;
⑵ 在 0.1mol·L-1的亚硝酸溶液中加入少量NaNO2固体后,溶液的pH将 ;
⑶ 将50mL 0.1mol·L-1的亚硝酸溶液和50mL 0.1mol·L-1的亚硝钠溶液混合后,向其中加入1 mL0.01mol·L-1的盐酸溶液或NaOH溶液,溶液的pH将 (选填“变化很大”或“几乎不变化”),理由是 ;
⑷ A、B两种盐分别由氢、氮、氧、钠四种元素中的三种元素组成,它们分别溶于水后得到的水溶液呈酸性或者碱性,且在相同温度下,A溶液的pH大于相同浓度B溶液的pH。若A、B两物质中不含相同的离子,则A的化学式为 ,B的化学式为 。
13.某温度(t℃)时,测得0.0l mol·L-1NaOH溶液的pH为11,则该温度下水的Kw = 。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合。
⑴ 若所得混合液为中性,且a=12,b=2,则Va︰Vb= ;
⑵ 若所得混合液为中性,且a+b=12,则Va︰Vb= ;
⑶ 若所得混合液的pH=10,且a=12,b=2,则Va︰Vb= 。
12.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG= lg{c(H+)/ c(OH-) },则下列叙述正确的是
A 中性溶液的AG=0
B 酸性溶液的AG<0
C 常温下0.lmol/L氢氧化钠溶液的AG=12 D 常温下0.lmol/L盐酸溶液的AG=12
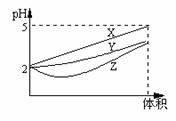
11.pH=2的X、Y、Z三种酸的水溶液各1mL,分别稀释到1000mL,其pH与体积的关系如图,则下列说法不正确的是
A、X是强酸,Y、Z是弱酸 B、原溶液浓度为Z>Y>X
C、电离程度X>Y>Z D、原溶液都是稀溶液
10.对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高20℃后,两溶液的pH均不变
C.加水稀释2倍后,两溶液的pH均减小
 D.加足量的锌充分反应后,两溶液中产生的氢气一样多
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
9.pH=2的两种一元酸HX和HY分别与足量锌粉反应,所生成的H2体积 V(HX)>V(HY)。下列说法正确的是
A.这两种酸的物质的量浓度一定相同而体积不同
B.酸的物质的量浓度c(HX)一定大于c(HY)
C.若两种酸体积相同,则HY的酸性比HX酸性强
D.HY一定不是弱酸
8.用pH试纸测定某氨基酸溶液的pH,如果先将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,溶液pH的测得值为8,则该氨基酸溶液的实际pH
A.等于8 B.小于8 C.大于8 D.小于7
7.常温时,将V1 mL cl mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(NH4+)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2
6.用体积相同、pH均为12的NaOH溶液和氨水,分别中和物质的量浓度相同的盐酸。当酸碱恰好完全反应时,NaOH溶液和氨水消耗盐酸的体积分别为V1和V2。则下列关系式正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com