
碱金属元素原子与同周期元素(稀有气体元素除外)相比,其原子半径较 ,易 (填“得到”或“失去”)最外层上的 个电子而形成 价的 离子,故皆为 (填“活泼”或“不活泼”)的金属元素,其单质都具有强 性。因其离子与晶体中的自由电子的作用(金属键)较弱,故碱金属都具有硬度 ,熔沸点
密度 的特点。同时,随着原子序数的 ,电子层数的 ,原子半径的 ,原子失去电子的能力逐渐 ,使碱金属的金属性
,单质的还原性 ,硬度依次 ,熔沸点依次
单质的密度由 到 。决定了锂是最 (填“轻”或“重”)的金属,只能保存在 ,也决定了铯是自然界中最 的金属。
17. (2006江苏25题)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
(2006江苏25题)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
⑴写出电解池A、电解池B和光催化反应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
16.工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,使废水中的铬含量达排放标准。
⑴ 试写出两极上的电极方程式;
⑵ Cr2O72-的酸性条件下有强氧化性,试写出Cr2O72-转变成Cr3+的离子方程式;
⑶ 废水由酸性变为碱性的原因是什么?试写出生成两沉淀的离子方程式;
⑷ 能否改用石墨电极?为什么?
15.将铝制品与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝制品和电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝制品表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝制品和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
⑴ 铝制品表面形成氢氧化铝薄膜的电极反应式为:____________________________;
⑵ 电解过程中,必须使电解液的pH保持相对稳定(不能太大或太小)的原因是 ;
⑶ 使用NaHCO3溶液为电解液,会减缓阴极区溶液pH的增大,能说明这一原理的离子方程式是 。
14.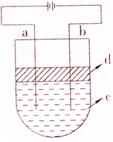 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色、纯净的Fe(OH)2沉淀。应用如右图的电解实验可制得纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色、纯净的Fe(OH)2沉淀。应用如右图的电解实验可制得纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
⑴ a电极材料应为_________,电极反应式为_________________;
⑵ 电解液c可以是___________。(填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶ d是苯(C6H6),其作用为_______,在加入C6H6之前对c应如何进行简单处理?_______;
⑷ 为了在较短时间内看到白色沉淀,可采取的措施是_______。(填编号)
A.改用稀硫酸做电解液 B.适当增大电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
⑸ 若c用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除在电极上可以看到气泡外,混合物中另一明显现象为____________。.
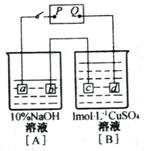
13.按右图装置实验:[A]、[B]两烧杯分别盛放10%NaOH溶液200g和1mol•L-1的CuSO4溶液500mL,a、b、c、d都是铂电极,通电一段时间后,在C极增重,又测出[A]杯中NaOH溶液的浓度变为10.23%,试回答:
⑴ 电源P为__________极;⑵b极放出气体_______L(标准状况);
⑶ c极的电极反应___________,c极增重__________g;⑷d极上的电极反应式____________,电极产物的质量为__________g;⑸通电后[B]池CuSO4的物质的量浓度为__________,H2SO4的物质的量浓度为__________;([B]池电解后溶液体积变化忽略不计)
12.近年来,加“碘”食盐主要使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和不锈钢为电极,以KI溶液(加少量K2CrO4)为电解液在一定条件下电解,反应方程式为:

KI+ H2O KIO3+3H2↑,下列有关说法正确的是
A.电解时,石墨作阴极,不锈钢作阳极
 B.电解液调节到酸性比较合适
B.电解液调节到酸性比较合适
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中每转移0.6mol电子,理论上可得到21.4g无水KIO3晶体
11.装置工作一段时间后,发现B池中有一极的质量减少。
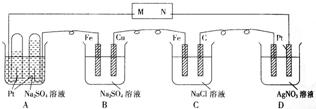 以下有关的推断中正确的
以下有关的推断中正确的
① M是电源的负极 ② B中Cu电极的质量减少 ③ C中溶液的pH升高 ④ D中溶液的pH下降 ⑤ B中电解液的浓度基本不变 ⑥ 相同条件下的A,C,D池中生成气体的总体积为C>A>D
A.只有⑤⑥ B.只有③④⑤⑥ C.全部 D.除②
10.(2000上海12)在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,基析出铜的质量为1.92g,则析出银的质量为
A.1.62g B.6.48g C.3.24g D.12.96g
9.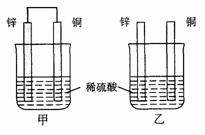 (2006上海13)将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
(2006上海13)将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com