
4.下列实验中,直接采用沾有水滴的仪器,对实验结果没有影响的是( )
A.氨的喷泉实验 B.实验室制氧气:试管
C.中和滴定:锥形瓶 D.中和滴定:滴定管
3.进行中和滴定时,事先不应该用所盛溶液洗涤的仪器是( )
A.酸式滴定管 B.碱式滴定管 C.锥形瓶 D.移液管
2.刻度“0”在上方的用于测量液体体积的仪器是( )
A.滴定管 B.温度计 C.量筒 D.烧杯
1.酸碱恰好完全中和时( )
A.酸与碱的物质的量一定相等
B.溶液呈中性
C.酸与碱的物质的量浓度相等
D.酸所能提供的H+与碱所能提供的OH-的物质的量相等
3.用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,下列操作不正确的是( )
A.用标准氢氧化钠溶液润洗碱式滴定管后再盛入标准碱溶液
B.用待测酸溶液润洗锥形瓶后再盛入待测酸溶液
C.用酚酞作指示剂,滴定终点时溶液颜色由无色变浅红色
D.读数时,视线应与滴定管凹液面的最低点保持水平
[课后作业]
2.下图为中学常用定量仪器的部分结构(有的仪器被放大),回答下列问题。

⑴ D的仪器名称是________________,A图中液面所示液体的体积为_________mL,
中学里用C图所示仪器的实验名称是__________ ____;
⑵ 在配制一定质量分数溶液的实验中,应用到上述仪器中的 ,如果读数时
视线偏高,则所得溶液的质量分数将 (填“偏大”“偏小”或“不变”);
⑶ 检查B图中的仪器是否漏水的方法是:__________________________ ___________。
1.(1995年上海市高考题)某学生中和滴定实验过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)加入待测的NaOH溶液,(d)记录液面刻度读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸润洗的洁净锥形瓶中,(g)加入适量的蒸馏水,(h)加入酚酞试液2滴,(i)滴定时,边滴边摇晃(j)边注视滴定管内液面的变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定,(l)记录液面读数,(m)根据滴定管内的两次读数得出NaOH溶液体积为22ml。指出上述实验过程中的错误之处(用编号表示)(选错一个倒扣一分,但不出现负分)
5.有关滴定操作的注意点:
⑴ 一般用标准液滴定待测液,但也可用待测液滴定标准液,只要操作正确一样能准确求出待测液浓度。
⑵ 进行误差分析时,务必抓住“V(标准液)”的变化,“V(标准液)”偏大,则测量值偏大;“V(标准液)”偏小,则测量值偏小。
⑶ 了解常用指示剂的变色范围以及使用:
甲基橙变色范围是 ;
石蕊变色范围是 ;
酚酞变色范围是 ;
一般来说,强酸与强碱用 ;强酸与弱碱用 ,强碱与弱酸用 ,石蕊不能作为中和滴定的指示剂。
⑷ 滴定操作不仅适用于酸碱中和反应,还可应用于其它类型的反应:比如,以 为指示剂,用Na2S2O3滴定I2(2 S2O32-+I2=S4O62-+ I-),到 为滴定终点;以KMnO4酸性溶液滴定Fe2+等还原性物质,无需另加指示剂,到 为滴定终点。
[典型例题]
[例1]用Na2CO3标准溶液滴定未知浓度盐酸,导致测定结果偏高的操作有( )
A.滴定前锥形瓶用蒸馏水润洗过
B.滴定前锥形瓶中加入待测盐酸后又加蒸馏水
C.滴定前读数方法正确,滴定后俯视读数
D.滴定前尖嘴中气泡未排除即进行滴定,滴定后尖嘴无气泡
[例2]用已知浓度的NaOH测定未知浓度的盐酸溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏高的是(锥形瓶中溶液用滴定管量取)( )
A. 酸式滴定管未用待测盐酸润洗
B.碱式滴定管未用标准碱液润洗
C.滴定过程中不慎有液体溅出
D.滴定前仰视读数,滴定后读数正确
[例3]已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
MnO4-+C2O42-+H+→Mn2++CO2↑+H2O(未配平)
 MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样
品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反
应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;
从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准
溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。
试回答下列问题:
⑴ 配平: MnO4-+ C2O42-+ H+― Mn2++ CO2↑+ H2O
⑵ 0.0200mol·L-1KMnO4标准溶液应置于 (选填“甲”或“乙”)滴定管中;判断滴定终点的依据是 ;
⑶ 你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”);
若回答“能”,请给出计算结果;若回答“否”,试说明原因 ;
⑷ 若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗
[当堂反馈]
4.中和滴定误差分析:根据中和滴定原理有:c (标准液)•V(标准液)=c (待测液)•V(待测液),
c (待测液)=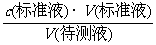 。由于c (标准液)、V(待测液)均为定值,所以c(待测液)的大小取决于
。
。由于c (标准液)、V(待测液)均为定值,所以c(待测液)的大小取决于
。
常见的因操作不对而引起的误差有:
① 未用标准酸润洗滴定管,则测量值 ;
② 用待测液润洗锥形瓶,则测量值 ;
③ 滴定管尖嘴处有气泡,滴定后消失,则测量值 ;
④ 滴定前读数正确,滴定后俯视读数,则测量值 ;
⑤ 滴定前读数正确,滴定后仰视读数,则测量值 ;
⑥ 滴定过程中待测液有损失,则测量值 ;
⑦ 到达滴定终点时,尖嘴处悬一滴标准液,则测量值 ;
⑧ 指示剂一变色即停止滴定,可能测量值 。
3.中和滴定的实验步骤(以标准盐酸滴定未知氢氧化钠为例)
⑴ 准备:① 检查酸式滴定管是否 ;② 洗净滴定管后要用 再润洗两到三次;③ 加标准液 ;④ 赶走 ,并将液面调节到 并计下读数;⑤ 用蒸馏水洗净锥形瓶,不能用待测液润洗。
⑵ 滴定:① 用量筒(或滴定管)取一定体积待测液于 中,滴入 ;② 用左手 ,右手 ,眼睛注视 ;③ 锥形瓶中溶液 且 ,停止滴定,计下刻度。
⑶ 计算:每个样品滴定2-3次,取平均值求出结果。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com