
6.据报道,摩托罗拉公司研发的一种同甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达到现在用镍氢或锂电池的十倍,可连续使用一个月才充一次电。该电池反应的离子方程式是2CH3OH+3O2+4OH-=2CO32-+6H2O。据此请判断下列说法正确的是
A.CH3OH在负极上失去电子,O2在正极上得到电子
B.溶液中OH-向正极移动,H+向负极移动
C.CH3OH发生还原反应,O2发生氧化反应
D.随着电极反应的不断进行,电解质溶液的pH值基本保持不变
5.常温下镀锌铁片表面破损发生析氢腐蚀时,若有0.2mol电子发生转移,下列说法一定正确的是
A.有5.6g金属被腐蚀 B.有4.48L气体放出
C.有6.5g金属被腐蚀 D.有2.24L气体放出
4.生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是
A.负极发生的电极反应可能是: O2+4e-+2H2O=4OH-
B.正极发生的电极反应可能是: O2+4e-=2O2-
C.负极反应主要是C6H12O6生成CO2或 HCO3-
D.正极反应主要是 C6H12O6生成 CO2或 CO32-
3.将铁棒与石墨用导线连接后,浸入0.1 mol·L-1的食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出 Cl2 D.石墨棒上放出O2
2.下列事实与电化腐蚀无关的是
A.光亮的自行车钢圈不易生锈 B.黄铜(Cu/Zn合金)制的铜锣不易产生铜绿
C.铜、铝电线一般不连接起来作导线 D.生铁比熟铁(几乎是纯铁)容易生锈
1.将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各项叙述正确的是
A.正极附近的SO42-浓度逐渐增大 B.负极附近的SO42-浓度逐渐减小
C.负极附近的SO42-浓度逐渐增大 D.正负极附近的SO42-浓度基本不变
3.银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理可除去硫化银。其处理方法是:将一定浓度的食盐溶液注入一铝制容器中,再将变黑的银器放在溶液中,放置一段时间后,黑色会褪去而银不会损失。则此原电池中,负极发生的反应为 ,正极发生的反应为 ,反应过程中产生臭鸡蛋气味,原电池总反应方程式为 。
课后练习:
2.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH――14e-=2CO32-+12H2O,2H2O+O2+4e-=4OH-,有关此电池的推断正确的是
A.电池工作过程中,溶液的pH值逐渐减小
B.正极与负极上参加反应的气体的物质的量之比为2∶7
C.通乙烷的电极为正极C2H6+18OH――14e-=2CO32-+12H2O
D.正极发生氧化反应
1.微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH―-2e-=ZnO+H2O ,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,判断下列叙述中,正确的是
A.在使用过程中,电池负极区溶液pH增大
B.在使用过程中,电流由Ag2O极经外电路流向Zn极
C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D.外电路中每通过0.2mol电子,正极的质量理论上减小1.6g
[例1]A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
⑴ A中反应的离子方程式为 ;
⑵ B中Sn极的电极反应式为_ __ ______,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)_________;
⑶ C中被腐蚀的金属是_______,总反应式为
;A、B、C中铁被腐蚀的速率又快到慢的顺序为 。
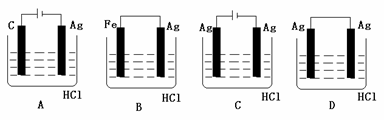
[例2]某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是
[例3]出现于20世纪50年代的镍(Ni)镉(Cd)电池是一种可充电碱性电池,至今仍占有很大的市场份额,但由于镉是致癌物质,故镍镉电池有逐渐被其它可充电电池取代的趋势。镍镉电池以氢氧化钾为电解质溶液,电池在充、放电时的工作原理为:

Cd(s)+2NiOOH(s)+2H2O(l) Cd(OH)2(s)+2Ni(OH)2(s)
下列关于镍镉电池的说法错误的是
A.电池工作时的负极反应是:Cd(s)+2OH-(aq)=Cd(OH)2(s)+2e-
B.充电时的阳极反应是:Ni(OH)2(s) +OH-(aq)=NiOOH(s)+H2O(l)+e-
C.作为电解池时电解质溶液质量增加,作为原电池时电解质溶液质量减少
D.电池工作时,负极区pH增大,正极区pH减小,但整个电池的pH基本保持不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com