
1、可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是C
( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是C
( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
1.(2)6
(3)9, 1.2
[课后作业] (测试时间45分钟 测试分值100分)
4、(1)2 a mol
3、在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)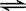 3Z(气),已知加入1 molX和3molY。达到平衡后,生成a
mol Z。
3Z(气),已知加入1 molX和3molY。达到平衡后,生成a
mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和8 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y, mol Z,才能使平衡时Z为0.9a mol。
14.(06南师附中一模)如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol
Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?) 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
cd
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
cd
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变小
2、已知N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol
21-6×0.9+3×0.9+6×0.9=24.3 等温等压时,体积与物质的量成正比,A、B总体积为24.3×a/18=1.35a,所以B的体积为:0.35a升
2NH3(g);△H=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol
21-6×0.9+3×0.9+6×0.9=24.3 等温等压时,体积与物质的量成正比,A、B总体积为24.3×a/18=1.35a,所以B的体积为:0.35a升
(4)升高温度向逆方向移动,会使平衡体系中气体物质的量增多,才会使B恢复原来反应前的N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入x mol N2 y mol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、 y的值为 c
A.1.5、6.5 B.2、8 C.5、21 D.3、13
[例1](06徐州一模 )将2 mol A和2
mol B充入某密闭容器中发生反应:2A(g) +
B(g)  xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是AD
xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是AD
A.若在恒温恒容下,当x = 1时,按1 mol B、l mol C作为起始物质,达到平衡后,C的体积分数仍为a
B.若在恒温恒容下,当x = 2时,将2 mol C作起始物质,达到平衡后,C的体积分数大于a
C.若在恒温恒容下,当x = 3时,2 mol B、6 mol C作起始物质,达到平衡后,C的体积分数不等于a
D.若在恒温恒压下,按3 mol A、3 mol B作起始物质,达到平衡后,C的体积分数仍为a,则x可为任意正整数
[例2] (06四县市联考)一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。

关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
[例3]如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答: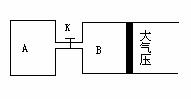
(1)B中X 的转化率α(X)B为
(2)A中W和B中Z的物质的量的比较:
n(W)A n(Z)B (填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是
[解析](1)平衡时B中总物质的量为:0.9a×18/a=16.2mol,设:参加反应的X为nXmol有:2∶1=nX∶(18-16.2) nX=3.6mol α(X)B=3.6/4= 90℅
(2)B平衡状态可视为A状态体系体积缩小一半形成的,而A体系体积缩小时,平衡向正方向移动,也就是B中Z的物质的量在2倍于A中Z的物质的量的基础上有所增加,又A中W物质的量是Z的2倍,所以B中Z的物质的量大于A中W的物质的量。
(3)打开K意味着A、B在等温等压下建立平衡,与B中平衡状态等效,A、B可视为一个容器,其中A的转化率仍为90℅,求得平衡时总物质的量为:6-6×0.9+体积。
[当堂反馈]
1、(06宿迁二模)恒温、恒压下,1molA和nmolB在一个容积可变的容器中发生如下反应:C
A(g)+2B(g) 2C(g)
|
一段时间后达到平衡,生成amolC。则下列说法中正确的是:A.物质A、B的转化率之比为1:2 B.起始时刻和达平衡后容器中的压强比为(1+n):(1+n- 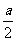 ) )C.若起始时放入3molA和3nmolB,则达平衡时生成3amolC D.当ν正(A)=2ν逆(C)时,可断定反应应达平衡 |
2、等效平衡的判断
|
类 型 |
全 等
平 衡 |
相 似
平 衡 |
|
|
等效效果 |
平衡混合物中相同物质的物质的量、含量对应相等 |
平衡混合物中相同物质的物质 的量比值相等、含量对应相等 |
|
|
外界条件 |
恒温恒容 |
恒温恒容 |
恒温恒压 |
|
反应特征 |
反应前后△V(g)、 △n(g)≠0 |
反应前后△V(g)、 △n(g)=0 |
反应前后△V(g)、 △n(g)=0或≠0 |
|
判断方法 |
|
|
1、等效平衡问题
在一定条件下(定温、定容或定温、定压),对同一可逆反应,虽然
,这样的平衡称为等效平衡。
17.(上海理综35、36、38)化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
① 以上反应是可逆反应 ② 以上反应不是可逆反应
③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A ①③ B ②④ C ①④ D ②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
(3)另一种常用的电池是锂电池(很是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电板材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成;电池总反应可表示为:Li+MnO2→LiMnO2
试回答:锂电池比容量特别大的原因是 锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com