
4.已知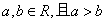 ,则下列不等式中成立的是( )
,则下列不等式中成立的是( )
A. B.
B.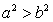 C.
C.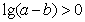 D.
D.
3.命题“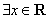 ,
,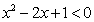 ”的否定是( )
”的否定是( )
A.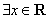 ,
,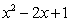 ≥0 B.
≥0 B.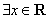 ,
,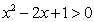
C. ,
,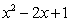 ≥0 D.
≥0 D. ,
,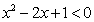
2.如果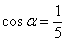 ,且
,且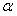 是第四象限的角,那么
是第四象限的角,那么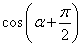 =( )
=( )
A.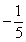 B.
B.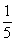 C.
C.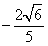 D.
D.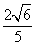
1.已知全集 ,则
,则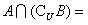 ( )
( )
A.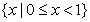 B.
B.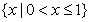 C.
C. D.
D.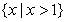
6.根据中和热的测定实验填空。
取0.55 mol/L的NaOH溶液50mL与0.5mol/L的盐酸50mL置于图3-4所示的装置中进行反应和测定中和反应的反应热。
(1)图3-4装置的名称是____________,装置中缺少的一种仪器是____________,装置中还存在的错误有____________,这种错误会造成最高温度读数____________(填“增大”、“减小”或“无影响”)。
(2)大烧杯杯口若不盖硬纸板,测得的中和热的数值将____________(填“偏大”、“偏小”或“无影响”)。
(3)假定0.5mol/L的盐酸和0.55mol/L的NaOH溶液的密度都是 1,反应前的温度为18℃,反应后最高温度为t,则中和热的计算式是△H=________________________。
(4)实验中,若改用60mL 0.5mol/L的盐酸进行实验,与上述实验结果相比,则放出的热量____________(填“增多”、“减小”或“相等”),测得的中和热____________(填“相同”或“不相同”)。
(5)实验中,将盐酸倒入NaOH溶液中,或将NaOH溶液倒入盐酸中,对实验结果____________(填“有影响”或“无影响”)。该溶液快速混合好还是慢混合好?______________。理由是____________________________________。
测定中和热属于定量实验,定量实验要求准确而误差小,否则有可能产生错误的结论。
(1)量热计 环形玻璃搅拌棒 大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎纸条 减小
(2)偏小 (3) (4)增多 相同(5)无影响 快速好 因为慢速混合导致较多热量散失
5.将4g甲烷和适量氧气混合后通入一密闭容器中,点燃使之恰好完全反应,待恢复到原温度后,测得反应前后压强分别为3.03×105Pa和1.01×105Pa,同时又测得反应共放出222.5kJ热量。试根据上述实验数据,写出该反应的热化学方程式。
3.下列说法或表示方法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B.在稀溶液中: H++OH-=H2O;△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ;
C.由C(石墨)→C(金刚石);△H=+119 kJ/mol 可知,金刚石比石墨稳定
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=+285.8kJ/mol
|
反应进程 |
|
反应过程中 反放出的能量 |
|
生成物能量总和 |
|
反应物能量总和 |
|
能量 |
A.反应过程中能量关系可用右图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时,正极放出
气体一定为11.2L
2.沼气是一种新能源,它的主要成分是甲烷。0.5 moLCH4完全燃烧生成CO2和H2O时,放出445 kJ热量,则下列热化学方程式中正确的是
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=+890 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=+890 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890 kJ/mol
D.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l);△H=-890kJ/mol
1.下列物质加入水中显著放热的是
A.固体NaOH B.生石灰 C.无水乙醇 D.固体NH4NO3
[例1] 下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.反应是放热还是吸热,由反应物的总能量和生成物的总能量的相对大小决定
D.放热反应中只有放热过程没有吸热过程
[例2]在同温同压下,下列各组热化学方程式中,△H1>△H2的是
A.2H2(g)+O2(g)==2H2O(g);△H1 2H2(g)+O2(g)==2H2O(l);△H2
B.S(g)+O2(g)==SO2(g);△H1 S(s)+O2(g)==SO2(g);△H2
C.C(s)+ O2(g)==CO(g);△H1 C(s)+O2(g)==CO2 (g);△H2
D.H2(g)+Cl2(g)==2HCl(g);△H1 H2(g)+ Cl2(g)==HCl(g);△H2
[例3]由氢气和氧气反应生成1mol水蒸气放热241.8kJ。写出该反应的热化学方程式:_______________。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+ O2(g)=H2O(1) 的△H= ,氢气的燃烧热为 。
[例4]化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/
kJ·mol–1 |
197 |
360 |
499 |
X |
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如上图所示,则上表中X= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com