
22、(16分)50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
⑴大小烧杯间填满碎泡沫塑料的作用___ ___。
 ⑵ (填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。其原因是 。
⑵ (填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。其原因是 。
⑶大烧杯上如不盖硬纸板,对求得中和热数值的影响是 (填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量 (“增加”、“减少”或“不变”),理由是 ;
所求中和热数值 (“增加”、 “减少”或 “不变”),理由是 。
21、 (8分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
20.(共8分)(1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8 kJ,试写出相关的热化学方程式: 。
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________________________
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。该反应的热化学方程式__________________________________
(4)已知:O2(g)  O2+(g)+e-
△H1=+1175.7 kJ·mol-1
O2+(g)+e-
△H1=+1175.7 kJ·mol-1
PtF6(g)+e- PtF6-(g)
△H2=-771.1 kJ·mol-1
PtF6-(g)
△H2=-771.1 kJ·mol-1
O2PtF6(s) O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol-1
O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g)
 O2+PtF6-(s)的 △H=_____________
kJ·mol-1
O2+PtF6-(s)的 △H=_____________
kJ·mol-1
19.(6分)对于下列反应:2SO2
+ O2 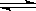 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ ______。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ ______。
18、体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
(
)
2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
(
)
A.等于P% B.小于P% C.大于P% D.无法判断
第II卷(非选择题 共46分)
17.已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A.1︰1 B.1︰2 C.2︰3 D.3︰2
16.已知:H+(aq)+OH-(aq)===H2O(l) △H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,,则△H1、△H2和△H3的大小关系为( )
A.△H1==△H2>△H3 B.△H3>△H2>△H1
C. △H2>△H1>△H3 D.△H3>△H1>△H2
15.已知有热化学方程式:SO2(g)+  O2(g)
O2(g)
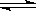 SO3(g) △H = -98.32kJ/mol,现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于
SO3(g) △H = -98.32kJ/mol,现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于
A.40% B.50% C.80% D.90%
14.对于可逆反应4NH3(g)+5O2(g)
 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4V正(O2)=5V逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2V正(NH3)=3V正(H2O)
13、向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) 3C(g);经2
s后达到平衡,测得C气体的浓度为0.6
mol·L-1。下列说法中正确的是
( )
3C(g);经2
s后达到平衡,测得C气体的浓度为0.6
mol·L-1。下列说法中正确的是
( )
①用物质A表示该反应的平均反应速率为- 0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为- 0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com