
19.在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的是
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的.并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为 (填“可行”或“不可行”)
理由是:
根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是
写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:
18.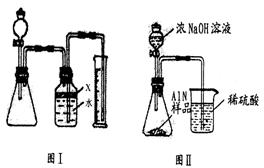 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ装置来进行实验,
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ装置来进行实验,
使氮化铝样品和NaOH溶液反应:
AlN+NaOH+H2O=NaAlO2+NH3↑,根据
反应中所生成氨气的体积来测定样品中
的氮化铝的质量分数,并根据实验现象
来确定杂质的成分(实验中导
管体积忽略不计)。(1)实验有关操作为:
a.往锥形瓶中放入适量的A1N样品
b.从分液漏斗往锥形瓶中加入过量的浓NaOH
c.检验装置的气密性
d.测定收集到水的体积
正确的操作顺序为 。
(2)广口瓶中的试剂x应选用
A.NaOH 溶液 B.酒精 C.植物油 D.CCl4
(3)广口瓶内的液体没有装满(上方留有少量空间),实验测得NH3的体积将
(填“偏大”、“偏小”或“不变”)。
(4)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是 。
(5)若实验中测得样品的质量为w g,氨气的体积为a mL(标况下),则样品中AIN的百分含量为 。
(6)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AIN的质量分数。你认为是否可行? (填“可行”或“不可行”)。原因是
,改进的方法为
17.在100mLamol/L的AlCl3溶液中加入100m Lbmol/LNaOH溶液。
(1)当b≤3a,生成Al(OH)3沉淀的物质的量为
(2)当a 、b满足 条件时,先有沉淀生成,后又有部分沉淀溶解,此时的质量为
16.铝和铁在地壳中的含量仅次于氧和硅,居于第三位和第四位,现代生活离不开它们。根据铝、铁单质及其化合物的性质和用途。回答下列问题。
(1)向灼热的铁丝喷洒水,用化学方程式表示 。[y1]
(2)氢氧化铝是几乎不溶于水的白色胶状物,但它易溶于强酸或强碱溶液,请用离子方程式表示 , 。
(3)明矾 可用于净水。在明矾的水溶液中滴入紫色石蕊试液,溶液呈 色,这是因为(用离子方程式表示)
;再加热,观察到的现象是
,简述原因
。
可用于净水。在明矾的水溶液中滴入紫色石蕊试液,溶液呈 色,这是因为(用离子方程式表示)
;再加热,观察到的现象是
,简述原因
。
15.将6.6gMg、Al合金投入到500 mL 2 mol·L-1的盐酸中,金属完全溶解,再加入4 mol·L-1
NaOH溶液,若使生成的沉淀最多,则加入这种NaOH溶液的体积是 ( )
A.200 mL B.250 mL C.425 mL D.560 mL
第Ⅱ卷(55分)
14.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是 ( )
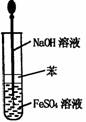
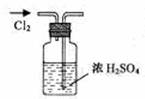
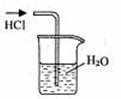
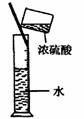
A.干燥Cl2 B.吸收HCl C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
13.工业上冶炼金属,常用的方法有四种:(I)热分解法 (Ⅱ)热还原法 (Ⅲ)电解法 (Ⅳ) 湿法冶金。下表中金属与其制备方法相符的是 ( )
|
|
金 属 |
制备方法 |
|
A |
钾、钙 |
Ⅳ |
|
B |
钠、铝 |
Ⅲ |
|
C |
铜、铁 |
I |
|
D |
镁、汞 |
Ⅱ |
12.把ag铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为ag,则原合金中铁的质量分数为 ( )
A.30% B.47.6% C.52.4% D.70%
11.下列物质充分反应后,滴入KSCN溶液,显红色的是:①FeS+HCl(溶液)
②FeCl2(溶液)+Cl2 ③Fe+CuSO4(溶液) ④Fe2O3+H2SO4 ( )
A.②④ B.①② C.③④ D.①④
10.对于反应Fe +H2SO4=FeSO4+H2↑,下列方法不能加快反应速率的是 ( )A.给溶液加热 B.不用铁片,改用还原铁粉
C.加人少量硫酸铜 D.不用稀硫酸,改用98 %浓硫酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com