
10.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.31克白磷分子中所含共价键数NA
D. 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
9.把0.6 mol气体X和0.4 mol气体Y混合于2.0 L密闭容器中,发生如下反应:
3X(g)+Y(g) nZ(g)+2W(g) 测得5min末时生成0.2 mol W,又知以Z表示的平均反应速率为0.01
mol·(L·min)-1,则n值是
nZ(g)+2W(g) 测得5min末时生成0.2 mol W,又知以Z表示的平均反应速率为0.01
mol·(L·min)-1,则n值是
 A.1 B.2 C.3 D.4
A.1 B.2 C.3 D.4
8.能使反应Cu+2H2O=Cu(OH)2+H2 发生的是
A.铜片作阴、阳极,电解质溶液为CuCl2溶液
B.铁片作正极,Cu片作负极,电解质溶液为氯化铜溶液
C.用铜片作阴、阳极,电解质为NaOH溶液
D.铜锌合金在潮湿空气中发生电化学腐蚀
7.把下列四种X溶液,分别加进四个盛有10mL浓度为2mol·L-1的盐酸的烧杯中,并都加水稀释至50mL,相同条件下X和盐酸缓慢地进行反应,其中反应速率最大的是
A.10mL、2mol·L-1 B.10mL,4mol·L-1
C.20mL,2mol·L-1 D.20mL,3mol·L-1
6.下列能用勒夏特列原理解释的是
 A.溴水中有下列平衡Br2+H2O HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅
A.溴水中有下列平衡Br2+H2O HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
5.从下列事实所列出的相应结论正确的是
|
|
实 验
事 实 |
结
论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->HAlO2或Al(OH)3 |
|
D |
SO2通入KMnO4溶液,溶液褪色 |
SO2具有漂白性 |
4.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl D.CCl4和KCl
3.25 ℃时,水的电离达到平衡:H2O  H+ + OH- ;ΔH > 0 ,下列叙述正确的是
H+ + OH- ;ΔH > 0 ,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
2.根据表中信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.热稳定性:H2T<H2R B.单质与稀盐酸反应的速率为L<Q[
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
1.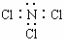 下列化学用语书写正确的是
下列化学用语书写正确的是
A.次氯酸的结构式:H-Cl-O B.NCl3的电子式为
C.Cl原子的结构示意图为  D. 氢硫酸的电离方程式:H2S+H2O=H3O++HS
D. 氢硫酸的电离方程式:H2S+H2O=H3O++HS
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com