
30.有一硫酸与硝酸的混合溶液,取10 mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66 g的沉淀;滤液与2.0 mol·L-1 NaOH溶液反应,用去25 mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10 mL原混合液,加入3.2 g铜粉共热时,在标准状况下收集到气体的体积为多少毫升?
衡阳市八中2010届高三第四次月考
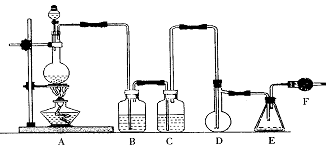
(1)装置A中发生反应的化学方程式为 。
(2)装置B应盛放的药品是 ,C中是 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50-59℃.最好采用 方式加热。
(5)F装置中干燥管内所盛物质是 ,作用是 。
28.(12分)单质A在适宜条件下有如图所示的一系列转化,其中F是一种红褐色物质。
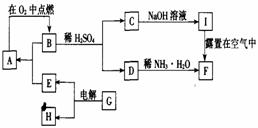
(1)写出下列物质的化学式:A ,B 。
(2)用化学方程式表示下列转化过程
B+H2SO4→C+D:___________________________。
I露置在空气中转化为F:___________________________。
(3)G可能是_________或_________;
27.(10分)W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子Y的阴离子核外电子数为18,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素。它们能形成两种气态化合物;
④X是形成化合物最多的元素,且W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。请回答:
(1)W元素是 ;Z元素是 。
(2)化合物WY和WX2中WY的电子式是 。
(3)Y和Z形成的两种常见化合物,其中可作漂白剂使用的化合物分子式是 。
(4)写出X的最高价和Z形成的化合物的结构式 。
26、(6分)1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+ +H2O ②SbCl5+HF→SbF5+
③2K2MnF6+4SbF5= 4KSbF6+2MnF3+F2↑ 请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为 ;
(2)反应③中的氧化剂为 ;被氧化的元素为 。
25.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物
C.元素Y、R分别与元素X形成的化合物的热稳定性XmY > XmR
D.元素W、R的最高价氧化物的水化物都是强酸
24.已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g)
△H2=-393.5KJ/mol
(3) H2(g)+  O2(g)=H2O(l) △H3=-285.8KJ/mol
O2(g)=H2O(l) △H3=-285.8KJ/mol
试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H
A.-488.3 KJ/mol B. +488.3KJ/mol C. -245.7KJ/mol D. +245.7KJ/mol
23.下列组合能形成明显喷泉并充满烧瓶的是
|
|
烧瓶中干燥气体 |
烧杯中液体 |
|
A |
二氧化氮 |
水 |
|
B |
二氧化硫 |
4 mol/LNaOH |
|
C |
氯气 |
饱和食盐水 |
|
D |
二氧化碳 |
水 |
22.下列化合物中,阳离子与阴离子的半径比值最小的是
 A.CsI B.LiI
C.CsF
D.NaF
A.CsI B.LiI
C.CsF
D.NaF
21.在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.①②③ B.②①③ C.③②① D.③①②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com