
3、任何原子的原子核都是由质子和中子构成的吗?怎样理解原子的质量主要集中在原子核上?
2、分子一定比原子大吗?
1、分子能否保持物质的所有性质? 只有分子保持物质的化学性质吗?
4、NaCl和HCl的形成
|
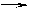 钠原子(Na) 电子
钠离子(Na+)阳离子
钠原子(Na) 电子
钠离子(Na+)阳离子
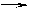
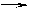 氯原子(Cl) 电子
氯离子(Cl-)阴离子
氯原子(Cl) 电子
氯离子(Cl-)阴离子
|
 氢原子(H)
氢原子(H)
 氯原子(Cl)
氯原子(Cl)
3、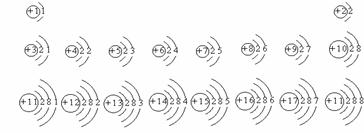 下面为核电荷数为1-18的元素的原子结构示意图 (请在其下面填写元素名称和元素符号)
下面为核电荷数为1-18的元素的原子结构示意图 (请在其下面填写元素名称和元素符号)
2、原子的结构
 ①每个质子相对原子质量约等于1,约等于一个 原子的质量。
①每个质子相对原子质量约等于1,约等于一个 原子的质量。
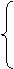 质子 ②每个质子带一个单位的 电荷。
质子 ②每个质子带一个单位的 电荷。
③决定 种类。
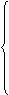
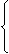 原子核
①每个中子相对原子质量约等于1,约等于一个氢原子的质量。
原子核
①每个中子相对原子质量约等于1,约等于一个氢原子的质量。
原 中子 ② 电荷。
③决定同类元素中的不同种原子。
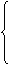 子
①质量约等于 (或 )质量的1/1836。
子
①质量约等于 (或 )质量的1/1836。
②每个电子带一个单位的 电荷。
③核外电子分层排布, 最外层电子数决定 的性质。
原子中:核电荷数 = 数 = 数
相对原子质量≈质子数 + 中子数。(为什么?)
阳离子:核电荷数=质子数>核外电子数
阴离子:核电荷数=质子数<核外电子数
自然界的物质是由微粒构成的, 、 、 是构成物质的三种基本微粒。
1、分子、原子、离子的区别与联系
|
|
分 子 |
原 子 |
离 子 |
||
|
区 别 |
概 念 |
保持物质 性质的 微粒 |
是化学变化中的 微粒 |
带电的 或 |
|
|
化学变 化中是 否可分 |
在化学变化中 分,变化前后种类和数目可能发生变化。 |
在化学变化中 分,变化前后种类和数目不发生变化。 |
在化学变化中单原子离子一般不可分,但原子团构成的离子可能分割成其它离子、原子或分子。 |
||
|
是否独 立存在 |
能独立存在,构成物质并保持物质的化学性质不变。 |
有些能独立存在,并直接构成物质,且能保持物质的化学性质不变。 |
阴阳离子共同构成物质。 |
||
|
构 成 |
同种原子或不同种原子通过共用电子对形成。且纯净物中仅含有一种分子。 |
一般有 、 和核外电子三种微粒构成。 |
由原子得失电子形成,原子得电子带 电荷成为 离子,原子失去电子带 电荷,成为 离子。 |
||
|
所显电 性情况 |
电性 |
电性 |
阴离子:带 电荷 阳离子:带 电荷 |
||
|
表 示 方 法 |
用 (分子式)表示 |
用 或原子结构示意图表示。 |
分别以阴、阳离子符号或离子结构示意图表示。 |
||
|
系 |
在化学 反应中 的表现 |
在化学反应中原分子破裂
在化学反应中得失电子 分子 原子 离子 在化学反应中重新组合成新分子 在化学反应中得失电子 |
|||
|
表 达 方 法 |
均为微观粒子,既可讲个数,又可论种类。 |
||||
|
基 本 属 性 |
体积 ,质量 ,都是在不断 的,微粒之间有 。同种微粒 相同,不同种微粒性质不同。 |
4、从微观角度简单认识NaCl和HCl的形成过程。
3、 准确描述原子的构成,知道原子核外的电子是分层排布的,认识常见原子的原子结构示意图。
2、 会用分子、原子的知识解释日常生活中的一些现象。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com