
4、下列过程中,需要增大化学反应速率的是( )
A、钢铁的腐蚀 B、食物腐败 C、塑料老化 D、工业合成氨
3、已知2SO2+O2=2SO3,若反应速率分别用v(SO2) 、 v(O2) 、 v(SO3)表示,则下列式子正确的是( )
A、2v(SO3)=v(O2) B、v(SO2)=v(O2)=v(SO3)
C、1/2v(SO2)=v(O2) D、v(O2)=2v(SO2)
2、已知反应A+3B 2C+D在某段时间内以A的浓率变化表示的化学反应速率为
2C+D在某段时间内以A的浓率变化表示的化学反应速率为 ,则此段时间内以C的浓率变化表示的化学反应速率为
,则此段时间内以C的浓率变化表示的化学反应速率为
A.0.5 B.
B. 
C.2 D.3
D.3
1、反应4 (气)+5
(气)+5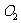 (气)
(气)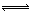 4NO(气)+6
4NO(气)+6 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 (X)(反应物的消耗速率或产物的生成速率)可表示为---------[C]
(A)
(X)(反应物的消耗速率或产物的生成速率)可表示为---------[C]
(A)  (NH3)=0.0100mol.L-1.s-1 (B)
(NH3)=0.0100mol.L-1.s-1 (B)  (O2)=0.0010mol.L-1.S-1
(C)
(O2)=0.0010mol.L-1.S-1
(C)  (NO)=0.0010mol.L-1.s-1 (D)
(NO)=0.0010mol.L-1.s-1 (D)  (H2O)=0.045mol.L-1.s-1
(H2O)=0.045mol.L-1.s-1
2、我们知道的改变反应速率的措施有∶加热、搅拌、增大反应物的浓度、使用催化剂、汽车加大油门、炉膛安装鼓风机、把煤块粉碎后使用、用冰箱保存食物、糕点盒装小包除氧剂等等。
思考与探究
提出问题∶在这节课我们的学习中,知道物质的浓度不同,反应速率也不同,那么影响反应速率的因素除了内因外,外因究竟有哪些呢?这是我们要研究的另一个问题。请同学们回去先复习必修2之专题二相关知识,然后预习下节内容。
[推荐作业]
3、溶液中,常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。
实验分析∶(实验2一1)
结论:反应物(指气体和液体,不含纯液体和固体)的浓度越大,反应时间越短,反应速率越快。
习题练习∶19页练习1一5题
小结:
(1)在同一反应中用不同物质来表示时,其数值可以不同,但都表示同一个反应的速率.因此,表示化学反应的速率时,必须说明反应物中哪种物质做标准.不同物质的速率的比值一定等于化学方程式中相应的化学计量数之比.
(2)一般来说,化学反应速率随反应的进行而逐渐减慢.因此,某一段时间内的反应速率,是平均速率,而不是指瞬时速率.
(3)化学反应速率一般不能用固体或纯液体表示。
预习第二节影响化学反应速率的因素
2、科学仪器测定(如颜色的深浅、光的吸收和发射、导电能力等);
化学反应的速率是通过实验测定的。测定方法有∶
1、直接观察某些性质(如释放出气体的体积和体系压强);
如反应方程式∶mA+nB=pY+qZ
则 VA= ,VB= ,
VY= ,VZ= 。
例析:
密闭容器中,合成氨反应∶
N2 + 3H2 = 2NH3
起始浓度(mol/L) 8 20 0
5min后(mol/L) 6
浓度变化(mol/L)
则 V(N2)=△C/△t= ;
V(H2)=△C/△t= ;
V(NH3)=△C/△t= 。
由以上可知∶ V(N2): V(H2 ): V(NH3)=
学与问∶
一个化学反应的速率用不同的反应物或生成物来表示,数值可能 但含义 , 速率之比等于该反应方程式中对应 之比。
练习
(1)在一定条件下,密闭容器中合成氨,3H2+N2==2NH3,开始时测得C(H2)=4mol/L ,C(N2)=1mol/L,2S末,测得C(N2)=0.9mol/L。求V(H2)为多大?
(2)实验室利用氯酸钾制氧气。某学生测得生成氧气的平均速率为0.01mol/L·min,氧气的密度约为1.28g/L,欲制取500mL(标态下)的氧气,需要时间为 ( )
A、2min B、4min C、6min D、8min
(3)向2L的密闭容器(内有催化剂)充入2mol的SO2和1molO2,经2S,测得容器内有1mol的SO3,则该反应的速率可怎样表示?
(4)在下列过程,需要加快化学反应速率的是 ( )
A、钢铁腐蚀 B、塑料老化 C、食物腐烂 D、工业炼钢
(5)某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线。由图中数据分析,该反应的化学方程式为____ ;反应从开始计时,
2分钟内Z的平均反应速率为____ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com