
(三)将分组实验改为单人实验。这样做使每个学生都能亲自动手操作而且独立进行。它有利于培养良好的学习习惯,使学生们懂得:办任何事情都要有目的、有计划,还要有坚持到底的决心。最重要的是有利于培养独立工作的能力,这也是本身所急需培养的一种能力。
(二)将演示实验改为边讲边实验。一些演示实验的现象不明显,可见度校尽管操作较简单,但如果由教师在前面做,学生们在下面观察,效果就会很不好。而把它改成边讲边实验,效果就很显著,由不受学生欢迎到很受学生欢迎。
(一)演示实验本来是由教师在课堂上做并指导学生观察的实验,在初学时,这种演示实验必须由教师亲手去做,它对于以后的学生实验有着示范的作用。到了一定阶段,在学生们做了几个分组实验之后,就可以最大限度地将演示实验转化为学生在教师指导下完成的演示实验。初三学生的好奇心强,富有参与精神,很乐于自己动手做实验,而且每次实验的成功都给他们带来无比的欣喜。一些学生在前面做实验,下面的同学也仿佛自己在做实验,全部注意力都集中在一起,使得整个课堂的教与学融为一体。动手做实验的学生由于是在全体同学面前做实验,注意力特别集中,收效特别好。这不仅创造和培养了他们的观察能力、思维能力和实际操作能力,也锻炼了他们大胆、心细、勇于表现的良好品质。
与验证性实验相反,探索性实验具有明显的优越性。(一)实验前学生不知道实验的现象和结果,这就要求他们认真、正确地操作,仔细敏捷地观察,忠诚老实地记录。谁不认真谁就不能获得正确的结论,这有利于培养他们科学实验的基本品格。(二)有利于发展智力,培养能力。化学实验的现象总是多方面的,而这些复杂的现象又是人们认识物质变化的向导。探索性实验不仅要求有一定的操作能力、观察能力,还要求把观察实验的过程和抽象思维的过程结合起来,要求有“去粗取精、去伪存真、由此及彼、由表及里”的分析方法,通过宏观现象,认识到微观世界的本质变化,把感性认识上升到理性高度。
“探索法”的教学过程,不是简单地、直接地让学生去掌握前人的科学结论,而是要引导学生“像以前的科学家”那样,通过实验探索规律、发现真理。例如,我在讲二氧化碳的实验室制法时,事先准备了如下几组实验:(一)碳酸钠与稀盐酸反应;(二)纯碳酸钙粉末与稀盐酸反应;(三)石灰石与稀盐酸反应;(四)石灰石与浓盐酸反应;(五)石灰石与稀硫酸反应。让五名学生到前面来依次分别做这五个实验,然后让同学们共同讨论:在实验室条件下制取二氧化碳选用哪组实验最合适?为什么?在经过讨论和争论之后,同学们得出共同的结论:实验室应用石灰石(或大理石)跟稀盐酸反应制取二氧化碳最适合。从而不仅使学生们牢固地掌握了二氧化碳的实验室制法,而且也使学生们学会了对比实验和优化实验的方法。
14. 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2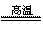 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
13. 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
[答案]B
[解析]由于Fe2+的还原性强于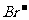 ,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化
,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化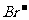 。2Fe2+ + Cl2
。2Fe2+ + Cl2
 2Fe3+ + 2
2Fe3+ + 2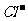 ,2
,2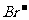 + Cl2
+ Cl2  Br2 + 2
Br2 + 2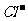 ,2FeBr2 + 3Cl2
,2FeBr2 + 3Cl2  2FeCl3 + 2Br2 。当x/a
≤0.5时,Cl2仅氧化Fe2+,故A项正确21世纪教育网
2FeCl3 + 2Br2 。当x/a
≤0.5时,Cl2仅氧化Fe2+,故A项正确21世纪教育网
当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;
当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
[考点分析]氧化性强弱比较氧化还原反应的相关计算21世纪教育网
12. 一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
[答案]B
[解析]此题类型属于信息给予题,据题意并结合提示,H2C2O4为二元弱酸,可写出氢氧化钠与KHC2O4·H2C2O4·2H2O反应的方程式:
6NaOH+2KHC2O4·H2C2O4·2H2O=3Na2C2O4+K2C2O4+8H2O;
10[KHC2O4·H2C2O4]+8KMnO4+ 17H2SO4=8MnSO4+9K2SO4+40CO2+32H2O 。可得关系式:6NaOH~2KHC2O4·H2C2O4·2H2O,10[KHC2O4·H2C2O4]~8KMnO4 ;综合以上两式可得:15NaOH ~ 4KMnO4 , 结合题意:V(NaOH)=3V(KMnO4)可得出关系:
15NaOH ~ 4KMnO4
15 4
3V(KMnO4)×0.1000mol·L-1 V(KMnO4)×c(KMnO4)
列式得:15×V(KMnO4)×c(KMnO4)=4×3V(KMnO4)×0.1000mol·L-1,整理得:0.08000mol·L-1,答案选B。
[考点分析]氧化还原反应的滴定
11. 2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8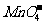 +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
6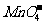 +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:

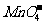 +
+ Fe2++
Fe2++ H+
H+ Mn2++
Mn2++ Fe3++
Fe3++ H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________ g。
(4)混合物中Cu2S的质量分数为_________。
[答案](1)1 5 8 1 5 4 (2)0.007 (3)19.6 (4)40%
[解析]根据配平后的离子方程式,KMnO4-5(NH4)2Fe(SO4)2,则剩余KMnO4的物质的量为: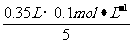 =0.07 mol。
=0.07 mol。
需称量固体的质量为:0.5 L×0.1 mol·L-1×392 g·mol-1=19.6 g21世纪教育网
假设混合物中Cu2S的物质的量为x,CuS的物质的量为y,结合以上数据列出方程组:
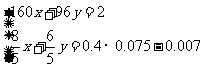 ,解得结果
,解得结果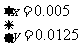 ,则混合物中Cu2S的质量分数为:
,则混合物中Cu2S的质量分数为: ×100%=40%。
×100%=40%。
[考点分析]氧化还原反应的配平及综合计算
10. a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g
②(a+b)×189 g ③(a+b)mol ④(Vc-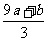 )mol
)mol
A.①④ B.②③
C.①③ D.②④
[答案]D
[解析]由元素守恒知:未被还原的硝酸将转化为Fe(NO3)3中的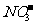 ,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n(Fe(NO3)3)=n(Fe)=(a+b) mol,所以未被还原的硝酸的质量=3 (a+b) mol×63 g·mol-1=(a+b)×189 g,②正确;又根据化合价升降守恒知
,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n(Fe(NO3)3)=n(Fe)=(a+b) mol,所以未被还原的硝酸的质量=3 (a+b) mol×63 g·mol-1=(a+b)×189 g,②正确;又根据化合价升降守恒知
a mol 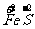 →a mol
→a mol 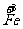 (NO3)3+a mol
(NO3)3+a mol 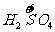 升高(3-2)a+(6+2)a=9a mol
升高(3-2)a+(6+2)a=9a mol
b mol 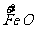 →b mol
→b mol 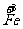 (NO3)3 升高(3-2)b=b mol
(NO3)3 升高(3-2)b=b mol
x mol H 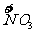 →x mol
→x mol 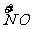 降低(5-2)x
mol=3x mol
降低(5-2)x
mol=3x mol
得9a mol+b mol=3x mol,即显氧化性的硝酸的物质的量x=(9a+b)/3
mol,所以未被还原的硝酸为(Vc-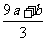 )mol,④正确21世纪教育网
)mol,④正确21世纪教育网
[考点分析]本题以元素化合物知识为载体,考查守恒法技巧。
9. 一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-=== 2Fe2+。据此,回答下列问题:
⑴将反应Zn+2H+ === Zn2++H2↑拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑵将反应3NO2+H2O == 2H++2NO3-+NO拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑶已知某反应的两个“半反应式”为:CH4+10 OH--8e-===CO32-+7H2O,O2+2H2O+4e-=== 4OH-,则氧化还原反应方程式为 。
[答案]⑴Zn-2e-=== Zn2+,2 H++2e-=== H2 。
⑵2NO2+2H2O-2e-=== 4H++2 NO3-;NO2+2 H++2e-=== NO+H2O
⑶CH4+2O2+2OH-=== CO32-+3H2O
[解析]⑵注意电子得失守恒、粒子数目守恒以及物质的选择与系数调整。在反应3NO2+H2O ===2 H++2 NO3-+NO中,只有1个NO2分子作氧化剂,有2个NO2分子作还原剂。2个NO2分子变为2个NO3-离子时,需2个H2O分子提供2个O原子,2个 H2O分子中的4个H原子则变为4个 H+离子。1个NO2分子变成1个NO分子时,另1个O原子需要与2个 H+离子结合成水。所以,有以上“半反应”。⑶前式 + 后式×2即得
[考点分析]氧化还原反应理解21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com