
1. 离子方程式正误判断主要抓住二个原则,一是符号书写是否正确,包括:①原理是否正确②化学式与离子形式拆合是否正确,二是是否守恒,包括原子守恒、电荷守恒,氧化还原反应还要转移电子守恒。
离子方程式的判断正误类型的题目,可总结为“八查”: (1)一查反应是否符合客观事实 如钠投入CuSO4溶液中:
2Na+Cu2+=2Na++Cu (×) 2Na+Cu2++2H2O= 2Na++Cu(OH)2↓+H2↑(√)
(2)二查质量是否守恒、电荷是否守恒、得失电子是否守恒 如Fe2++Cl2=Fe3++2Cl- (×) 2Fe2++Cl2=2Fe3++2Cl-(√)
(3)三查化学符号(↑、↓、=、  、化学式、离子形式)使用是否正确,如碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑(×) HCO3-+H+=H2O+CO2↑(√)
、化学式、离子形式)使用是否正确,如碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑(×) HCO3-+H+=H2O+CO2↑(√)
(4)四查是否忽略隐含的离子反应 如CuSO4溶液和Ba(OH)2溶液反应:Ba2++SO42-=BaSO4↓(×)
Cu2++ +Ba2++2OH-=Cu(OH)2↓+BaSO4↓(√)
(5)五查阴、阳离子配比是否正确
如稀H2SO4和Ba(OH)2溶液反应:H++SO42-+OH-+Ba2+=BaSO4↓+H2O (×)
+Ba2++2OH-=Cu(OH)2↓+BaSO4↓(√)
(5)五查阴、阳离子配比是否正确
如稀H2SO4和Ba(OH)2溶液反应:H++SO42-+OH-+Ba2+=BaSO4↓+H2O (×)
2H++ +2OH-+Ba2+=BaSO4↓+2H2O(√)
(6)六查反应物用量与其反应是否一致。如碳酸氢钙溶液中加入少量氢氧化钠:
Ca2++2
+2OH-+Ba2+=BaSO4↓+2H2O(√)
(6)六查反应物用量与其反应是否一致。如碳酸氢钙溶液中加入少量氢氧化钠:
Ca2++2 +2
+2 =CaCO3↓+
=CaCO3↓+ +2H2O(×)
+2H2O(×)
Ca2++ +
+ =CaCO3↓+H2O (√)
(7)七查加入试剂顺序与其反应是否一致。如往Na2CO3溶液中滴入少量稀盐酸:
2H++
=CaCO3↓+H2O (√)
(7)七查加入试剂顺序与其反应是否一致。如往Na2CO3溶液中滴入少量稀盐酸:
2H++ =H2O+CO2↑(×) H++
=H2O+CO2↑(×) H++ =
= (√)
(8)八查反应条件与其反应是否一致。如往氯化铵溶液中滴入烧碱溶液:
(√)
(8)八查反应条件与其反应是否一致。如往氯化铵溶液中滴入烧碱溶液:
 +
+ =NH3↑+H2O (×)
=NH3↑+H2O (×)  +
+
 NH3·H2O (√)
2. 离子方程式正误判断型试题,所给离子方程式常见的错误有:①不能正确使用化学式与离
NH3·H2O (√)
2. 离子方程式正误判断型试题,所给离子方程式常见的错误有:①不能正确使用化学式与离
子符号;②反应前后电荷不守恒;③反应原理不正确或反应不符合实际;④忽略反应物相对量的影响。
要注意几个特殊问题:
①离子反应不但可以发生在离子与离子间,也可以发生在离子与原子、离子与分子之间。如:Fe+2H+===Fe2++H2↑,C12+2I-===2Cl-+I2。
②有些反应从离子方程式看,好像没有离子参加,但实际上却是离子反应。如2Na+2H2O===2Na++2OH-+H2↑,实质是钠与水电离出的H+反应,只不过因为水是难电离的,要保留化学式
③相同物质之间的化学反应,在一种条件下是离子反应,在另一种条件下就不一定是离子反应,如:21世纪教育网
HCl(aq)+NH3(aq)===NH4C1(aq)离子反应 HCl(g)+NH3(g)===NH4Cl(s)分子反应
④复分解型离子反应因生成难溶物质、难电离的物质或挥发性物质,均使溶液中自由移动的离子数目减少,但这仅是一般规律,并不是绝对的。如以下反应中:CH3COOH+NH3·H2O===NH +
+ +H2O,自由移动的离子数目反而增加。
+H2O,自由移动的离子数目反而增加。
22.(本小题满分12分)
已知抛物线 的顶点在原点
的顶点在原点 ,焦点与椭圆
,焦点与椭圆 的右焦点重合.
的右焦点重合.
(Ⅰ)求抛物线 的方程;
的方程;
(Ⅱ)抛物线 的轴上是否存在定点
的轴上是否存在定点 ,使过点
,使过点 的动直线与抛物线
的动直线与抛物线 相交于
相交于 两点时,都有
两点时,都有 .若存在,求
.若存在,求 的坐标;若不存在,请说明理由.
的坐标;若不存在,请说明理由.
21.(本小题满分12分)
设函数 ,其中
,其中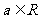 .
.
(Ⅰ)若 在
在 处的切线
处的切线 与直线
与直线 垂直,求切线
垂直,求切线 的方程;
的方程;
(Ⅱ)若 在
在 上不是单调函数,求
上不是单调函数,求 的取值范围.
的取值范围.
20.(本小题满分12分)
甲乙两队参加奥运知识竞赛,每队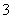 人,每人回答一个问题,答对者为本队赢得一分,答错得零分.假设甲队中每人答对的概率均为
人,每人回答一个问题,答对者为本队赢得一分,答错得零分.假设甲队中每人答对的概率均为 ,乙队中
,乙队中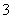 人答对的概率分别为
人答对的概率分别为 ,且各人正确与否相互之间没有影响.用
,且各人正确与否相互之间没有影响.用 表示甲队的总得分.
表示甲队的总得分.
(Ⅰ)求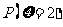 ;
;
(Ⅱ)用 表示“甲、乙两个队总得分之和等于
表示“甲、乙两个队总得分之和等于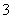 ”这一事件,用
”这一事件,用 表示“甲队总得分大于乙队总得分”这一事件,求
表示“甲队总得分大于乙队总得分”这一事件,求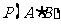 .
.
19.本小题满分12分)
设数列 、
、 满足:
满足:  ,
, ,
,
(1)求数列 和
和 的通项公式;
的通项公式;
(2)若数列 的前
的前 项和为
项和为 ,求
,求 .
.
18.(本小题满分12分)
如图,正方形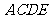 所在的平面与平面
所在的平面与平面 垂直,
垂直, 是
是 的中点,
的中点, ,
,
且 .
.
(Ⅰ)求证: 平面
平面 ;
;
(Ⅱ)求二面角 的大小.
的大小.


17.(本小题满分10分)
在△ 中,角
中,角 所对的边分别为
所对的边分别为 ,已知
,已知 ,
, ,
, .
.
(Ⅰ)求 的值;
的值;
(Ⅱ)求 的值.
的值.
16.已知函数 在
在 和
和 处分别取得极值,若
处分别取得极值,若 ,
,
 ,则
,则 的取值范围是_______.
的取值范围是_______.
15.在直角三角形 中,
中, ,
, 为斜边
为斜边 的中点,则
的中点,则 的值为_______.
的值为_______.
14.棱长都等于 的正三棱柱的外接球的体积为_______.
的正三棱柱的外接球的体积为_______.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com