
2. The officers narrowly escaped ___________ in the hot battle.
A. have killed B. to kill C. to be killed D. being killed
1. The children do not know how to _______ themselves decently at the party.
A. act B. perform C. behave D. advance
3.(09年广东化学·23) 磷单质及其化合物的、有广泛应用。
(1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
; H
H
①上述反应中,副产物矿渣可用来 。
②已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSio3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
 用△H1、△H2和△H3表示
用△H1、△H2和△H3表示 H,
H, H=
。
H=
。
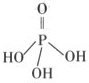
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个水分子产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;原理上的不同点: ;化学镀的优点: 。
[答案](1)水泥;△H1-3△H2+18△H3(2)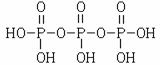 ,Na5P3O10,(3)+1;2Ni2+
+ 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
,Na5P3O10,(3)+1;2Ni2+
+ 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
[解析](1)①由方程式可以看出副产物矿渣应该是CaSiO3(s),结合炼铁我们不难得出答案是制水泥21世纪教育网
②运用盖斯定律,反应1-反应2×3+反应3×18=总反应,则△H=△H1-3△H2+18△H3
(2)结合题意三聚磷酸钠(俗称“五钠”)可知产物三聚磷酸应含有五个羟基,即三个
磷酸分子之间有三个羟基相互反应脱去两个水分子,所以三聚磷酸的结构式为
 ,三聚磷酸钠的化学式为Na5P3O10。
,三聚磷酸钠的化学式为Na5P3O10。
(3)①因为Na、H的化合价为+1,O为-2,所以由化合价代数和为0可得P的化合价为:+1。
②由得失电子数目守恒(2-1)×2=(3-1)×1,可知Ni2+ 和Ni+的化学计量数为2,H2PO2-和H2PO3-的化学计量数为1,再由电荷守恒2×2-1=2×1-1+2×1,可知H+在方程式的右边,H2O在方程式的左边,化学计量数分别为2和1。即总方程式为:2Ni2+ +1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+
③比较化学镀与电镀应该从反应环境和条件以及反应实质和产物方面去分析归纳问题,从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍-磷合金,这是两者的不同;从原理上分析,无论电镀还是化学镀均有电子的转移,均是利用了氧化还原反应,这是两者的相同点,不同点是化学镀用的是化学反应,而电镀用的是电化学;很明显化学镀装置简单,而且不需要消耗电能,装置简单、耗能少、操作简便应该是化学镀优于电镀的21世纪教育网
[考点分析]有关化学反应热的综合应用题。
21世纪教育网
2. 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH3CH
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2=32.4 kJ·mol-1
CH(g ) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)21世纪教育网
[答案]
(1)124.2
(2)C3H8+5O2=3CO2+4H2O 负
(3)4.2×10-7 mol·L-1
(4)> HCO3-+H2O=CO32-+H3O+(或HCO3-=CO32-+H+)、HCO3-+H2O=H2CO3+OH-,HCO3-的水解程度大于电离程度
[解析](1)将第2个方程式颠倒反写,然后与第1个方程式相加,即得所求的反应C3H8(g)====CH3CH=CH2 (g)+H2(g),△H也随方程式的变化关系进行求算:△H=-△H2+△H1=124.2kJ.mol-1。
(2)以丙烷为燃料制作的新型燃料电池,其电池反应方程式为C3H8十502=3C02+4H20,因电子从电池的负极经导线流入了电池的正极,故电池的正极是电子富集的一极,故带负电荷的离子 在电解质溶液中应移向电池的负极而不是正极21世纪教育网
在电解质溶液中应移向电池的负极而不是正极21世纪教育网
(3)根据电离平衡常数公式可知:
K1=c(H+)c(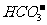 )/c(H2CO3)=10-5.60×10-5.60/l.5×10-5=4.2×10-7mol.
L-1。
)/c(H2CO3)=10-5.60×10-5.60/l.5×10-5=4.2×10-7mol.
L-1。
(4)0.1 mol L-1NaHCO3溶液的pH大于8,说明溶液呈碱性,即c((OH-)>c(H+),因在NaHCO3溶液中存在着两个平衡:电离平衡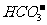 -
- CO32-+H+,水解平衡:
CO32-+H+,水解平衡: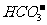 +H20
+H20  H2CO3+(OH- ,其余部分水的电离忽略不计,由c((OH-)>c(H+),说明水解过程大于电离过程,从而推出c(H2CO3)>c(
H2CO3+(OH- ,其余部分水的电离忽略不计,由c((OH-)>c(H+),说明水解过程大于电离过程,从而推出c(H2CO3)>c( )21世纪教育网
)21世纪教育网
[考点分析]热化学方程式书写、电极方程式书写、电离平衡常数、溶液中离子浓度大小比较21世纪教育网
1. 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一21世纪教育网
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)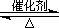 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni=由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:


请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
[答案](1)①800L·mol-1 ②= (2)1.60NA(或1.6NA) 173.4 (3)MFe2Ox+SO2→MFe2O4+S
[解析](1)据题意当容器中总压强为0.10MPa时,SO2的平衡转化率为0.80,据此可计算得出平衡时c(SO2)=0.040mol·L-1;c(O2)=0.020mol·L-1;c(SO3)=0.16mol·L-1。根据平衡常数的计算式:K=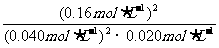 =800L·mol-1;只要温度不变,平衡常数就不改变,在此变化过程中,只有压强的改变,温度未发生变化,故K(A)=K(B)。
=800L·mol-1;只要温度不变,平衡常数就不改变,在此变化过程中,只有压强的改变,温度未发生变化,故K(A)=K(B)。
(2)用标准状况下4.48LCH4还原NO2 至N2,4.48LCH4的物质的量为0.20mol,在此过程中CH4中碳元素的化合价有-4价升高到+4价,转化为CO2,失去电子的总物质的量为0.20mol×8= 1.60mol,故转移电子数为1.60NA。由题目给知的热化学方程式,根据盖斯定律可以得出CH4还原NO2至N2的热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1,则0.2molCH4反应放出的热量为867 kJ·mol-1×0.2mol=173.4kJ。
(3)此题中反应物已知为MFe2OX和SO2,反应后生成MFe2O4,由MFe2OX转化为MFe2O4,氧原子数增加,故SO2失去氧原子转化为S,反应式为:MFe2OX+SO2=MFe2O4+S。
[考点分析]平衡常数、反应热、氧化还原反应方程式书写。
24. ⑴北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
①丙烷脱氢可得丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应总方程式为

 ;放电时,CO32-移
;放电时,CO32-移
向电池的 (填“正”或“负”)极。
⑵反应A(g)+B(g) 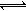 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
①该反应是_______________反应(填“吸热”“放热”);
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小”“不变”);
③反应体系中加入催化剂对反应热是否有影响?_____________,原因是______________
______________________________________________________________________ ____。
[答案]
⑴ ①124.2 ②C3H8+5O2=3CO2+4H2O 负
⑵ ①放热 ②减小 减小
③不影响 催化剂不改变平衡的移动
[专题综合]
23. 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
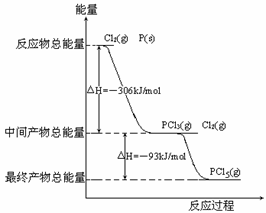 根据右图回答下列问题:
根据右图回答下列问题:
(1)原子最外层电子均达到8电子结构的分子是
(选填“PCl3”或“PCl5”)。
(2)P和Cl2反应生成PCl3的热化学方程式
______ _。
(3) PCl5分解成PCl3和Cl2的热化学方程式__________________ _ 。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________ ___ __。
[答案]
. (1)PCl3
(2) P(s)+Cl2(g)=== PCl3(g);△H=-306kJ·mol-1
(3) PCl5(g)===PCl3(g)+Cl2(g);△H=+93kJ·mol-1
(4)PCl5+4H2O===H3PO4+5HCl。
22. 现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。
请回答下列问题:
(1)元素B在周期表中的位置是_____________________,元素D的原子结构示意图为_________________________。
(2)A、D、E 3种元素形成一种离子化合物,其水溶液呈碱性,试用离子方程式表示该溶液中存在的所有平衡______________________________________
________________________________________________________________。
(3)A2C比A2E沸点高的原因是______________________________________。
(4)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为_________________________________,负极的电极反应式为______________________________;该电池在放电过程中,电解质溶液的pH将___________(填“增大”、“减小”或“不变”)。
(5)化合物B2A4和B2C4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。1 mol B2A4与B2C4完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为
_________________________________________________________________。
[答案]

21. 反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
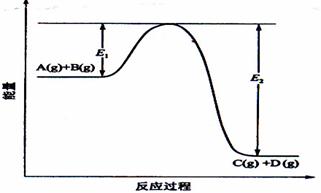
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),原因是________________________________________________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_____________________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_____,E2______(填“增大”“减小”“不变”)。
[答案]
(1)放热。
(2)减小;该反应正反应为放热反应,升高温度使平衡向逆反应方向移动。
(3)不影响;催化剂不改变平衡的移动。
(4)减小、减小。
20. 工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g)===Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
[答案]D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com