
5.缩聚反应-缩水结链式
许多个相邻小分子通过羧基和氨基,或羧基和羟基,或醛基和酚中苯环上的氢原子---的相互作用,彼此间脱去水分子后留下的残基顺序连接成长链高分子,这可称为缩水结链式.
4.氧化反应----脱氢重键式/氧原子插入式
醛的氧化是在醛基的C---H键两个原子间插入O原子;醇分子脱出氢原子和连着羟基的碳原子上的氢原子后,原羟基氧原子和该碳原子有多余价电子而再形成新共价键,这可概括为脱氢重键式/氧原子插入式.
3.消去反应---脱水/卤化氢重键式
有机分子(醇/卤代烃)相邻两碳原子上脱去水/卤代氢分子后,两个碳原子均有多余价电子而形成新的共价键,可概括为脱水/卤化氢重键式.
2.加成反应――开键加合式
有机分子中含有碳碳双键,碳氧双键(羰基)或碳碳叁键,当打开其中一个键或两个键后,就可与其他原子或原子团直接加合生成一种新分子,这可概括为开键加合式
1.取代反应---等价替换式
有机分子里某一原子或原子团与另一物质里同价态的原子或原子团相互交换位置后就生成两种新分子,这种分子结构变化形式可概括为等价替换式.
5.铜的主要用途
铜在电气和电子工业中主要用于制造电线、通讯电缆等。这方面应用占铜的工业总用量的一半左右,半导体器件中的硅芯片上用铜代替铝线;建筑业上用铜制造水管及其它排水设施,具有独特的杀菌功能,抑制细菌生长。
4.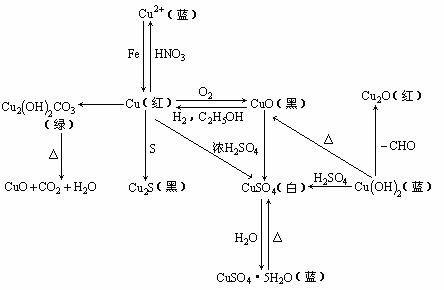 铜及其化合物之间的转化关系:
铜及其化合物之间的转化关系:
例3. 在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,则m1与m2之间的关系是( )
(A)m1一定大于m2 (B)m1可能m2
(C)m1一定等于m2 (D)m1可能大于m2
解析 铁和铜的混合物与一定量的硝酸反应,当金属剩余时,硝酸耗尽,但生成物中有硝酸亚铁或硝酸铜或这两种物质的混合物。若再向其中加入稀硫酸,则继续发生如下反应:
3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
或:3Fe +8H++2NO3- = 3Fe2++2NO↑+4H2O
Fe +4H++NO3- = Fe2++NO↑+2H2O
使金属质量减少。所以m1一定大于m2。所以答案为A。
3.铜的化合物的化学性质
(1) 氧化铜
a. 氧化铜有金属氧化物的性质,例如:
CuO+2HCl= CuCl2 +H2O
b. 氧化铜具有氧化性,可与某些还原剂反应。例如:

 H2 +CuO Cu+ H2O
H2 +CuO Cu+ H2O
 C +2CuO 2Cu+ CO2
↑
C +2CuO 2Cu+ CO2
↑
c. 氧化铜在高温下可发生分解反应: 4CuO 2Cu2O+ O2 ↑
|
实验内容 |
实验现象 |
结论 |
产物推测 |
|
用酒精灯加热装在试管中的CuO,收集生成的气体 |
黑色固体变为红色固体,收集的气体可使带火星的木条复燃 |
4CuO=Cu2O+O2↑(高温条件反应) |
CuO发生分解反应,红色固体为Cu2O,气体可使带火星的木条复燃 |
(2) 硫酸铜
CuSO4 晶体与无水CuSO4 之间可以相互转化
CuSO4·5H2O  CuSO4 + 5H2O
CuSO4 + 5H2O
CuSO4 + 5H2O = CuSO4·5H2O
|
|
实验内容 |
实验现象 |
结论 |
|
CuSO4·5H2O → CuSO4 |
向饱和的CuSO4 溶液中慢慢滴入浓硫酸,静置 |
液体分为两层,上层蓝色,下层无色,有白色固体析出 |
浓硫酸具有吸水性,可使饱和的CuSO4 溶液析出白色CuSO4 固体 |
|
CuSO4→ CuSO4·5H2O |
向无水CuSO4 中通入水蒸气 |
白色粉末变为蓝色晶体 |
CuSO4+5H2O= CuSO4·5H2O |
2.铜的化学性质
 (1) 与非金属单质反应
(1) 与非金属单质反应

 2Cu+O2 2CuO 2 Cu+S Cu2S Cu+Cl2 CuCl2
2Cu+O2 2CuO 2 Cu+S Cu2S Cu+Cl2 CuCl2
(2) 与酸反应
a. 与非氧化性酸(稀盐酸、稀硫酸)不反应。
b. 与氧化性酸反应
Cu + 2H2SO4(浓)  CuSO4 + SO2 ↑+ 2H2O
CuSO4 + SO2 ↑+ 2H2O
Cu + 4HNO3 (浓) = Cu(NO3)2 + 2NO2 ↑+ 2H2O
3Cu + 8HNO3 (稀) = 3Cu(NO3)2 +2 NO ↑+ 4H2O
(3) 与盐溶液反应
Cu+2FeCl3 = CuCl2 +2FeCl2
(4) 铜在干燥空气中性质稳定,但在潮湿空气中会被腐蚀,在其表面逐渐形成一层绿色的铜锈。
2Cu+ O2 +H2O + CO2 = Cu2(OH)2CO3
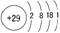 铜是人类发现最早的金属之一,也是最好的纯金属之一。铜元素在元素周期表中位于第四周期第ⅠB族,原子结构示意图为:
铜是人类发现最早的金属之一,也是最好的纯金属之一。铜元素在元素周期表中位于第四周期第ⅠB族,原子结构示意图为:
电子排布式为:1s22s22p63s23p63d104s1
1.铜及其化合物的颜色
铜是硬度较小的紫红色金属,具有良好的延展性、导电性和导热性

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com