
21.有一包红色粉末为Fe2O3和Cu2O的混合物。
⑴某实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为 ▲ 。(用字母a、b表示)
⑵实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知:
|
难溶物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
Ksp |
2.2×10-22 |
4.87×10-17 |
2.6×10-39 |
所以只除去溶液中的铁离子而铜离子不受影响,需要将溶液的pH调节到( )(填字母)(已知浓度小于10-5 mol/L,则可认为该离子基本除干净)
A.3-4 B.5-6 C.7-8 D.9-10
实验室有下列试剂可供选择:A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3
实验小组设计如下实验方案:(已知:Cu2O+H2SO4=Cu2SO4+H2O Cu2SO4=Cu+ CuSO4)
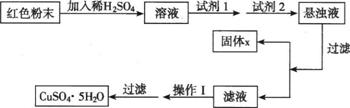
试回答:
①试剂2为 ▲ (填字母)。加入试剂1所发生的有关离子方程式 ▲ ,
这样设计的原理是: ▲ 。
②固体X的主要成分(填化学式) ▲ 。③操作Ⅰ ▲ 。
0.2mol上述I题中两种A盐的混合溶液500ml时,若此电池工作一段
时间后消耗23g Na 。则阳极产生气体体积为 ▲ L(标准状况下);
电解后溶液加水稀释至2 L,溶液的pH为 ▲ 。
20.I:已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B  M+D+E;②M+E→A+F+B 请针对以下两种不同情况回答:
M+D+E;②M+E→A+F+B 请针对以下两种不同情况回答:
⑴若A是一种钠盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为__▲__,反应②的离子方程式为______▲_____。
⑵若A是一种含氧酸盐,可用于实验室中检验水的存在.反应①中电极上会析出红色固体。
则其电解反应方程式是:____▲____。
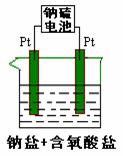 II:有一种新型的高能电池--钠硫电池(熔融的钠、硫为两极,以
II:有一种新型的高能电池--钠硫电池(熔融的钠、硫为两极,以
 Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:
Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:
2Na+xS Na2Sx,用该电池作电源电解(如右图)分别含有
19.用右图所示简易装置进行反应热测定实验,请回答下列问题: ⑴大小烧杯之间填满碎泡沫塑料的作用是 ▲ ,从实验装置上看,
图中缺少的一种玻璃仪器是 ▲ 。 ⑵使用补全仪器后的装置进行实验,取50mL 0.25mol/L
H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行
中和反应,三次实验温度平均升高3.4℃。已知中和后生成
的溶液其 比热容为4.18 J·g-1·℃-1),溶液的密度均为1g
·cm-3。通过计算可得中和热△H= ▲ ,H2SO4与NaOH
反应的热化学方程式为 ▲ 。 ⑶实验中若60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH
溶液进行反应,与上述实验相比,所放出的热量 ▲ (填“相等”、
“不相等”),所求中和热 ▲ (填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代
替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ▲ (填“偏大”、“偏小”、“不
受影响”)。
18.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是 ( )
A.由反应可确定:氧化性HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:
5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
|
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为12e-
非选择题(共46分)
17.下列溶液中微粒的物质的量浓度关系一定正确的是 ( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.pH=2的HA溶液与pH=12的MOH溶液等体积混合:
c(M+) = c(A-)>c(OH-) = c(H+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+2c(A2-)=c(OH-)+c(H2A)
16.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是 ( )
A.该电池Zn为负极,ZnO为正极,MnO2为催化剂
B.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时水分子和OH-不能通过薄层纸片
15.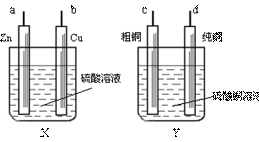 某学生用X、Y两装置(如右图)进行铜的电解精炼实验(粗铜中有锌、铁、镍、银等杂质),下列说法正确的是
( )
某学生用X、Y两装置(如右图)进行铜的电解精炼实验(粗铜中有锌、铁、镍、银等杂质),下列说法正确的是
( )
A.a应与c相连接,b应与d相连接 B.电解一段时间,b与d两极析出物质的物质的量相等 C.电解一段时间,b极附近溶液的pH降低 D.电解过程中,Y装置中Cu2+的浓度始终不变
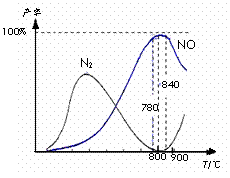
14.氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
 4NH3(g)+5O2(g)
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是 ( )
A.工业上氨催化氧化生成 NO时,温度应控制在
780-840℃之间
B.加压可提高NH3生成NO的转化率
C.工业上采用物料比n(O2)/n(NH3)在1.7-2.0,主要是为了提高反应速率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) △H=-181.5 kJ·mol-1
2NO(g) △H=-181.5 kJ·mol-1
13.下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强.速率的变化都符合示意图的反应是 ( )
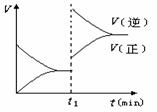 A. 2SO2(g)+O2(g)
A. 2SO2(g)+O2(g)
 2SO3(g);△H<0
2SO3(g);△H<0
B. 4NH3(g)+5O2(g)  4NO(g)+6H2O(g);△H<0
4NO(g)+6H2O(g);△H<0
C. H2(g)+I2(g)  2HI(g);△H>0
2HI(g);△H>0
D. C (s)+H2O(g)  CO(g) + H2(g);△H>0
CO(g) + H2(g);△H>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com