
8. 如果函数y=2tan(2x+φ)的图象关于点(π,0)对称,则|φ|的最小值为( )
A. B. C. D.0
7. 设x,y满足约束条件 , 若目标函数z=-ax+by(a>0,b>0)的值是最大值为 8,则+的最小值为( ).
A. B.2 C. D. 4
6.若互不相等的正数a,b,c成等差数列,a+1,b+1,c+5成等比数列,且a+2b+c=28,则a=( )
A.4 B.2 C.3 D.-4
5.函数f(x)=的单调减区间是( )
A.(0,) B.(,+∞) C.( ,1)∪(1,+∞) D.( ,1),(1,+∞)
4.设f(x)=,则f()+f(2x-1)的定义域为 ( )
A.[-3,3] B.[-1,]∪[,2] C.[-1,]∪(,2) D.[-3,3)
3.已知向量=(1,2),是不平行于x轴的单位向量,且·=2,则= ( )
A.(,) B. (,) C.(1,0) D.(,)
2.若△ABC的内角满足sin2A=,则sinA+cosA=( )
A. B.- C. D. 或-
1.设集合M={x|lgx<0},N={x|<2x<4},则( )
A.M∩N=φ B.M∩N=M C. M∪N=M D. M∪N=R
23.工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴下列叙述能够说明反应已经达到平衡状态的是 ▲ (填字母)
A.容器中密度不随时间变化 B.SO2与SO3的浓度相等
C.容器中SO2、O2、SO3的物质的量之比为2∶1∶2 D.反应容器中压强不随时间变化
⑵生产中为提高反应速率和SO2的转化率,下列措施可行的是 ▲ (填字母,下同)。
A.向装置中充入N2 B.向装置中充入过量的O2
C.使用更高效的催化剂 D.升高温度
⑶若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,
发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g) 、3.5 mol O2(g) 、1mol SO3 (g) ,下列说法正确的是 ▲
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑷生产中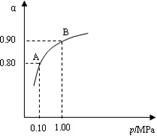 在550 ℃时,SO2转化为SO3的平衡转化率(α)与
在550 ℃时,SO2转化为SO3的平衡转化率(α)与
体系总压强(p)的关系如右图所示。将2.0 mol SO2
和1.0 mol O2置于5 L密闭容器中,反应达平衡后,
体系总压强为0.10 M Pa。试计算反应
2SO3 2SO2+O2
在550 ℃时的平衡常数K= ▲ 。
2SO2+O2
在550 ℃时的平衡常数K= ▲ 。
A、B表示不同压强下的平衡转化率,通常工业生产中采用常压
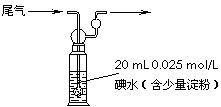 的原因是: ▲ ,并比较不同压强下的平衡常数:K(0.10 MPa) ▲ K(1.0
MPa)(填“<”或“>”或“=”)
的原因是: ▲ ,并比较不同压强下的平衡常数:K(0.10 MPa) ▲ K(1.0
MPa)(填“<”或“>”或“=”)
⑸硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时
需要加以处理后才能排放。现用右图所示装置测定尾气中
SO2的含量,当通入尾气11.2 L(标准状况下测定)时,
碘水恰好褪色。通过计算说明,该尾气能否直接排放(写
出计算过程)。 ▲
温州中学2009学年第一学期期中考试
22.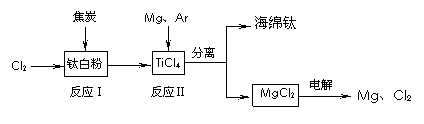 21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
⑴钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解
的离子方程式为 ▲ 。
 ⑵反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体该反应的化学方程式为 ▲ ;
⑵反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体该反应的化学方程式为 ▲ ;
反应Ⅱ的热化学方程式为 ▲ 。
⑶该工艺流程中,可以循环使用的物质有 ▲ 。
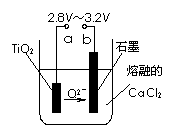
⑷在800℃-1000℃时电解TiO2也可制得海绵钛,装置如右
图所示。图中b是电源的 ▲ 极,阴极的电极反应式为
▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com