
3.6的烯烃或炔烃组成。它们可能有四种组合,根据每种组合中烷烃和不饱和烃的碳原子数及燃烧后生成CO2的体积可能有四种组合,根据每种组合中烷烃和不饱和烃的碳原子数及燃烧后生成CO2的体积可确定A和B的体积比。例如:若A为C4H10,B为C2H4。
设1升混合气中含C4H10为x L,含C2H4为(1-x)L,它们充分燃烧后分别得到4x升
CO2和2(1-x)L CO2,根据1升混合气燃烧后得到3.6LCO2,可得4x+2(1-x)=3.6
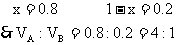
也可用十字交叉来解:

其它组合可依此类推,于是得到:
|
组合的编号 |
A的分子式 |
B的分子式 |
VA:VB |
|
① |
C4H10 |
C2H4 |
4∶1 |
|
② |
C4H10 |
C2H2 |
4∶1 |
|
③ |
C4H10 |
C3H6 |
3∶2 |
|
④ |
C4H10 |
C3H4 |
3∶2 |
(2)1L混合气可使含0.4mol溴的CCl4溶液完全褪色,说明混合气中不饱和烃与溴的
物质的量比为1∶2,符合这一条件的只有②、③的两种组合。
|
A的分子式 |
C4H10 |
C4H10 |
|
B的分子式 |
C2H2 |
C3H6 |
3.解析:
(1)本题是用计算推理方法确定混合烃的组成。1L碳原子数为n的烷烃或烯烃充分燃烧均得到nL CO2。由题意推断,该混合烃只能由碳原子数大于3.6的烷烃和碳原子数小于
8.15℃时,某2价金属硫酸盐的饱和溶液,其百分比浓度为25%,取足量的此饱和溶液,
加入1g这种硫酸盐的无水盐,结果析出了3.15g这种硫酸盐的含7个结晶水的晶体。通
过计算确定该金属是何种元素。
 b:设SO2极大过量,最终产物为NaHSO3
b:设SO2极大过量,最终产物为NaHSO3
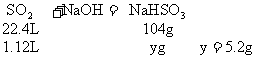
(2)讨论确定产物
a:因5.2<b<6.3,所以b g固体为Na2SO3和NaHSO3的混合物
b:因6.3<7所以7 g固体为Na2SO3和NaOH的混合物
(3)计算
a:第一种情况,设生成Na2SO3为xmol,NaHSO3为ymol

b:第二种情况:因NaOH过量,所以H2SO2完全反应。设参加反应的NaOH为amol,
生成Na2SO3为bmol,过量的NaOH为Cmol

7.已知NO2与NaOH溶液反应:
3NO2+2NaOH=2NaNO3+NO+H2O,NO和NO2可一起与NaOH溶液作用
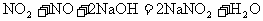 现欲用V L某烧碱溶液使由nmol NO和m
mol
现欲用V L某烧碱溶液使由nmol NO和m
mol
NO2组成的混合气体中的氮全部进入溶液中,NaOH溶液的物质的量浓度至少为多少?
6.在一定条件下,可逆反应达平衡: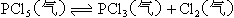 ,已知平衡混合气的平均分子量为149,求平衡混合气中PCl5的百分含量。
,已知平衡混合气的平均分子量为149,求平衡混合气中PCl5的百分含量。
5.镁条在空气中燃烧生成氧化镁和氮化镁。将燃烧后的产物溶解在60毫升浓度为2.0mol/
升的盐酸中,再用20毫升0.5mol/升NaOH溶液中和多余的盐酸,然后在此溶液中加过量的碱,把氨全部蒸出来,用稀HCl吸收,稀HCl增重0.17g,求镁带的质量。
4.丙烯和某种气态烃组成的混合气完全燃烧所需氧气的体积是混合气体的3倍(气体体积
均在相同状态下测定),求烃的分子式。
3.饱和烃A和不饱和烃B在常 温下均为气体,其中A含C原子数多于B。
温下均为气体,其中A含C原子数多于B。
(1)将A、B按一定比例混合。1L混合气完全燃烧后在同温、同压下得到3.6L CO2。试
推断该混合气的可能组合及A、B混合时的体积比。将结果填入下表。
|
A的分子式 |
B的分子式 |
VA∶VB |
|
|
|
|
(2)1mol该混合气体恰好能使含0.4mol溴的CCl4溶液完全褪色,推断上述组合中符合
该条件的A与B的分子式并填入下表
|
A的分子式 |
|
|
|
B的分子式 |
|
|
2.有不同浓度的NaOH溶液各取100mL分别通入SO2 1.12L(标况),完全反应后,分别得
到不含结晶水的固体6.00g和7.00g,求这两种溶液的不同浓度值(mol/L)?
1.一定量的钠、铝合金置于水中,合金全部溶解,得到20mL、pH=14的溶液。然后用1mol/L
的盐酸滴定至沉淀量最大时,消耗盐酸40mL。求原合金中钠的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com