
1.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
2.超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
⑴称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
⑵另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭 g。
思维方法: 。
展望高考:
[针对训练]
A.基础训练
1.孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且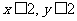 )
)
⑴孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: ;石青: 。
⑵现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO23.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定
该混合物中孔雀石和石青的物质的量之比。
思维方法: 。
展望高考:
2.常用计算方法:质量守恒法、平均值法、十字交叉法、极值法、推理法。
[例题解析]
[例1]要把12mol/L的盐酸(密度1.10g/cm3)50mL稀释成6mol/L 的盐酸
(密度1.10g/cm3),需加水( )
A.50mL B.50.5mL C.55mL D.59.5mL
解题思路: 。
易错点: 。
[例2]锌、铁、镁三种金属中的两种混合物13g,与足量的盐酸反应产生的氢
气在标准状况下为11.2L,则混合物中一定含有的金属是( ) (A)锌 (B)铁 (C)镁 (D)无法推断
解题思路: 。
易错点: 。
[例3]用向下排气法在容积为V mL的集气瓶中收集氨气,由于空气尚未
排净,最后瓶内气体的平均式量为19,将此盛满气体的集气瓶倒置于水中,瓶
内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体
积为( )
A. 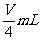 B.
B.
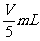 C.
C.
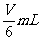 D.
无法判断
D.
无法判断
解题思路: 。
易错点: 。
[例4]取5.4克由某碱金属R及其氧化物R2O组成的混合物。该混合物与足量的水反应。反应完毕,蒸发反应后得到的溶液,得到8克无水晶体。试通过计算,判断该金属是哪一种碱金属?
.解题思路: 。
易错点: 。
[考题再现]
1.完成下图
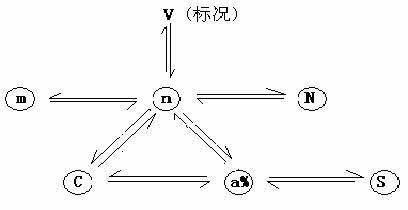
2.掌握物质的量应用于方程式的计算方法
教与学方案
[自学反馈]
1.掌握有关物质的量的综合计算的方法
10 A、电解水时生成2gH2和16gO2,则有 g水参加了反应
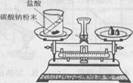
11 B、加热10g氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52g,则生成氧气的质量为 。
12 B、下列关于质量守恒定律的理解正确的是 ( )
A.l00mL水和l00mL酒精混合后,体积是200mL
B.将5gA和5gB混合发生化合反应,一定能生成l0gC '
C.木炭燃烧后质量减少了,这个化学反应不遵循质量守恒定律
D.红磷燃烧后生成产物的质量增加,是因为有氧气参与了反应
 13 A、课本96页书后习题第1(2)题
13 A、课本96页书后习题第1(2)题
14 C、小新用在空气中燃烧镁带的实验来探究质量守恒定律:
(1)镁带燃烧的符号表达式为 。
(2)完全燃烧后,称量留下固体的质量比反应前镁带的质量还轻,联系实验过程分析,其原因可能有: ;
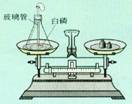 15 D、如图是测定白磷燃烧前后质量的变化情况验证质量守恒定律的实验。请回答:
15 D、如图是测定白磷燃烧前后质量的变化情况验证质量守恒定律的实验。请回答:
(1)白磷燃烧时的现象是
(2)锥形瓶底部铺少量细沙的目的是 ,橡皮塞上安装一根导管并系一个气球的目的是 。
(3)引燃白磷后要迅速用橡皮塞将锥形瓶塞紧,其理由主要有两点:① ,② 。
(4)当瓶子冷却到室温后打开瓶塞,会感到比平时费力,其原因是 。
2. 能灵活运用质量守恒定律解释、解决常见化学反应中的现象和问题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com