
读“某月4-10日气温变化示意图”,回答11-12题。

11.这次天气过程可能是由下列哪种天气系统过境造成的 ( )
A.冷锋 B.暖锋 C.气旋 D.反气旋
12.下图中哪幅图能反映该天气系统过境前后的气压变化 ( )
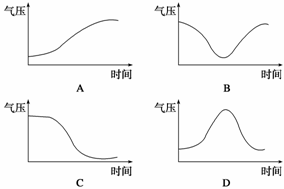
答案 11.A 12.A
团领导人峰会上就温室气体长期减排目标达成一致,寻求与《联合国气候变化框架公约》其他缔约国共同实现到2050年将全球温室气体排放量减少到至少一半的长期目标。据此回答8-10题。
8.下列不属于温室气体的是 ( ) A.二氧化碳 B.氟氯烃 C.臭氧 D.氮气
9.温室气体能产生温室效应的原因是 ( )A.它们能大量吸收可见光,使大气增温 B.使大气逆辐射的能力降低
C.使大气逆辐射的能力增强 D.以上叙述都不对
10.全球变暖是影响全球环境变化的最重要的环境问题。海平面上升是全球变暖的重要反映之一,它将不会影响到 ( )
A.海陆间水循环 B.北京到东京的飞行距离
C.台湾海峡的宽度 D.珠穆朗玛峰的海拔高度
答案 8.D 9.C 10.B
破坏植被等原因外,还与自然界周期性气候的演变有关。据此完成6-7题。
6.“自然界周期性气候的演变”是指 ( )
A.人类出现以前的气候变化 B.人类历史时期的气候波动
C.地球运动导致气温变化 D.产业革命以后世界气温出现的波动
7.250万年以来,冬季风为黄土搬运提供了强大的动力,夏季风带来丰沛的降水,加强了堆积物的成土作用。下列叙述正确的是 ( )
A.寒冷的冰期,黄土堆积速率很高,成土作用较弱
B.温暖的间冰期,黄土的堆积速率较高,成土作用相对加强
C.寒冷的冰期,为碎屑物质的搬运提供的动力小
D.温暖的间冰期,成土作用减弱
答案 6.B 7.A
(原创题)据研究,全球气候变暖是由于人类温室气体的排放。为此,2008年7月8日在日本举行的八国集
下图为“某区域等压线分布图”。读图回答3-5题。

3.M处气压数值可能为 ( )
A.1 000、1 010 B.1 010、1 015
C.1 015、1 020 D.1 020、1 000
4.图中①、②、③、④四地附近,可能出现锋面天气的是 ( )
A.① B.② C.③ D.④
5.图中①、②、③、④四地附近,风速最大的是 ( )
A.①地 B.②地 C.③地 D.④地
答案 3.B 4.C 5.D
刘东生院士根据中国黄土沉积,重建了250万年以来的气候变化历史。近年来我国沙尘暴频繁发生,除了人为
下图为“某地全年逐日逐时平均气温(30年平均)的等温线图”。这种气候图与其它气候图相比较,更能反映与农林生产相关的气温分布实况。回答1-2题。

1.该地7月的月均温约为 ( )
A.10°C B.15°C C.20°C D.25°C
2.该地最可能属于下列哪种气候类型 ( )
A.温带海洋性气候 B.温带季风气候
C.温带大陆性气候 D.亚热带季风气候
答案 1.B 2.A
14.有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,试回答:
⑴若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
⑵若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
⑶若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为___________。如果A分子每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为________________________。
13.2002年诺贝尔化学奖的一半奖金授予了瑞士科学家库尔特维特里希,以表彰他“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。核磁共振技术是利用核磁共振谱来测定有机化合物结构,最有实用价值的就是氢谱,常用HNMR表示,如:乙醚分子中有两种氢原子,其HNMR谱中有两个共振峰,两个共振峰的面积比为3:2,而乙醇分子中有三种氢,HNMR谱中有三个峰,三个共振峰之间的面积比为3:2:1。
(1)请写出分子式C4H8在HNMR谱中两个峰面种为3:1的化合物的结构简式______。
(2)C4H10的HNMR谱有两种,其中作液体打火机燃料的C4H10的HNMR谱的两个峰的面积比为__________,结构简式__________;其同分异构体的两个峰的面种比为_________,结构简式为________________________。
A. x:m:n=1:2:1
B.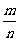 =
=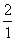 C.m≤2x+2 D.m>2x+2
C.m≤2x+2 D.m>2x+2
4.某气态烃10mL与50mL氧气在一定条件下作用,刚好耗尽反应物,生成水蒸气40mL,一氧化碳和二氧化碳各20mL(各气体体积均在同温、同压下测定),该烃的分子式为( )
A.
C3H8 B.C4H6
C.C3H6
D. C4H8
5.燃烧物质的量相等的某有机物和乙醇。①乙醇燃烧生成CO2的量是该有机物的三分之二。②该有机物燃烧生成水的量是乙醇的三分之二。③二者消耗相同状态下氧气的体积相同。通过分析判断该有机物是下列哪种( )
A.C4H9OH
B.CH2=CHCOOH
C.CH2=CHCHO
D. CH3CH2COOH
6.某化合物含碳、氢、氮3种元素,已知其分子内的4个氮原子排列成内空的四面体结构,且每2个氮原子间都有1个碳原子,分子中无C-C、C=C和C≡C键。则此化合物的化学式是( )
A.C6H12N4 B.
C4H8N4 C.C6H10N4 D.C6H8N4
7.某气态化合物X含有C、H、O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量。欲确定化合物X的分子式,所需的最少条件是( )
A.①②④
B.②③④
C.①③⑤
D.①②
8.常温、常压下,50mL 3种气态烃的混合物与足量的氧气混合后点燃爆炸,恢复到原来状况时,体积共缩小100mL,则3种烃可能是( )
A.CH4、C2H4、C3H4
B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H8
D.C2H4、C2H6、C2H2
9.某气态烃和具有一双键的气态烯烃组成的混合气体,在同温下对 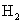 的相对密度为13,取标准状况下的此混合气体6.72L,通入足量的溴水,溴水增重7g,则此混合气体的可能组成是( )
A.C2H4和C2H6
B.CH4和C3H6 C.C3H8和C2H4
D.CH4和 C2H4
10. 某有机物X含C、H、O三元素,现已知下列条件:①含碳的质量分数 ②含氢的质量分数 ③蒸气的摩尔体积(折合成标准状况下的体积) ④X对氢气的相对密度 ⑤X的质量 ⑥X的沸点。确定X的分子式所需要的最少条件是( )
的相对密度为13,取标准状况下的此混合气体6.72L,通入足量的溴水,溴水增重7g,则此混合气体的可能组成是( )
A.C2H4和C2H6
B.CH4和C3H6 C.C3H8和C2H4
D.CH4和 C2H4
10. 某有机物X含C、H、O三元素,现已知下列条件:①含碳的质量分数 ②含氢的质量分数 ③蒸气的摩尔体积(折合成标准状况下的体积) ④X对氢气的相对密度 ⑤X的质量 ⑥X的沸点。确定X的分子式所需要的最少条件是( )
A.①② B.①③⑥ C.①②④ D.①②③④⑥
2、过量计算问题的判断法
(1) 计算法
(2) 比较法
(3) 极限判断法
(4) 中值判断法(过量讨论)
例2:58.5 g氯化钠跟17 g硝酸银在水溶液里发生反应,可生成多少摩氯化银沉淀?
解析:这是最简单的过量问题。这种题的解题思路是先要选量。选量的目的是确定反应物中过量物质和完全反应的物质。然后以完全反应的物质的量计算有关的量。要从物质的量观点去选量为好,可用物质的量的关系确定完全反应的物质和过量的物质。
n(NaCl)=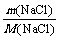 =
=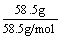 =1 mol,
=1 mol,
n(AgNO3)=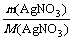 =
=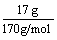 =0.1 mol,
=0.1 mol,
由NaCl+AgNO3=NaNO3+AgCl¯可知:NaCl过量,应以AgNO3计算。
n(AgCl)=n(AgNO3)=0.1 mol
答:能生成0.1mol氯化银沉淀。
当然更为简单的方法是比较大小,而不直接算出具体的数字。如:
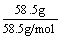 >
>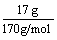 ,NaCl过量,应以AgNO3计算。
,NaCl过量,应以AgNO3计算。
例3:将a g H2与b g Cl2合成制得HCl气体,将反应所得的混合气体用足量NaOH溶液充分吸收。求:
(1) 剩余气体的质量;
(2) 混合气体与NaOH溶液反应所得NaCl的质量。
解析:这是属于第二种类型的一般过量讨论题。由于H2与Cl2的量皆已知,因此,反应后就存在三种情况:。完全反应、H2过量,Cl2过量。而反应后生成的HCl与Cl2能与NaOH溶液反应。
Cl 2+H2=2HCl
HCl+NaOH=NaCl+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
讨论:
① 若氢气与氯气恰好完全反应(或a∶b = 1∶35.5)时,无剩余气体,生成NaCl质量为:117b / 71(g);
② 若Cl2过量(或a∶b<1∶35.5=时,无气体剩余,生成NaCl质量为:58.5(35.5a+b) / 71(g);
③ 若氢气过量(或a∶b>1∶35.5)时,剩余气体为:(a-b / 35.5) g, 生成NaCl质量为:117b / 71 (g)
1、一般的过量计算: 两种物质反应,两反应物的量皆已知,求生成物的量,这是最简单的过量问题。这种题的解题思路是先选量,然后以完全反应的反应物的量计算有关量。选量的方法有多种,以采用物质的量进行比较为好。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com