
4.R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;
X2++ Z=X + Z2+;Y + Z2+=Y2+ +Z。这四种离子被还原成0价时表现的氧化性大小符合( )。
A. R2+>X2+>Z2+>Y2+ B. X2+>R2+>Y2+>Z2+
C. Y2+>Z2+>R2+>X2+ D. Z2+>X2+>R2+>Y2+
3. 关于C + CO2
点燃 2CO的反应,下列说法正确的是( )。
关于C + CO2
点燃 2CO的反应,下列说法正确的是( )。
A.是化合反应,不是氧化还原反应
B.CO既是氧化产物又是还原产物
C.单质C中C的化合价升高,被还原,是氧化剂
D.CO2中C的化合价降低,被氧化,CO2是还原剂
2.下列反应中,不属于氧化还原反应的是( )。

 A.2CO + O2 点燃 2CO2
B.CH4 +
2O2 点燃 CO2
+ 2H2O
A.2CO + O2 点燃 2CO2
B.CH4 +
2O2 点燃 CO2
+ 2H2O

 C.2KClO3 加热 2KCl + 3O2↑ D.2Fe(OH)3 加热 Fe2O3 +3H2O
C.2KClO3 加热 2KCl + 3O2↑ D.2Fe(OH)3 加热 Fe2O3 +3H2O
1.已知I-、Fe2+、SO2、Cl-、H2O2都有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2。则下列反应不能发生的是( )。
A.2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+
B.I2 + SO2 + 2H2O = H2SO4 + 2HI
C.H2O2 + H2SO4 = SO2 + O2 + 2H2O
D.2Fe2+ + I2 = 2Fe3+ + 2I-
2、物质的量相等的HBr和H2SO3
溶液中,中通入0.1mol Cl2 ,结果有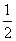 的Br-被氧化,求HBr的物质的量?
的Br-被氧化,求HBr的物质的量?
有机物化合价升降的计算
(1)得氧或失氢被氧化,每得1个O原子或失去2个H原子,化合价升高2。
(2)失氧或得氢被还原,每失去1个O原子或得2个H原子,化合价降低2。
例:CH3CH20H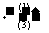 CH3CHO
CH3CHO 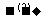 CH3COOH
CH3COOH
过程(1)是失氢,氧化过程,化合价升高1×2
过程(2)是得氧,氧化过程,化合价升高2×1
过程(3)是加氢,还原过程,化合价升高1×24
练习3
1、在100mLFeBr2 中通入Cl2 2.24L(STP),充分反应后,有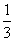 的Br-被氧化,则原FeBr2 的浓度是多少mol·L-1 (分别用电子得失相等和电解质溶液电荷守恒来解题)
的Br-被氧化,则原FeBr2 的浓度是多少mol·L-1 (分别用电子得失相等和电解质溶液电荷守恒来解题)
5、有关计算
在氧化还原反应中,氧化剂与还原剂得失电子数相等。这是进行氧化还原反应计算的基本依据。
举例:
3、氧化还原反应的基本规律
(1)表现性质规律
当元素具有可变化合价时,一般处于最高价态时只具有氧化性,处于最低价态时只具有原性,处于中间价态时既具有氧化性又具有还原姓。如:浓H2SO4的S只具有氧化性,H2S中的S只具有还原性,单质S既具有氧化性又具有还原性。
(2)性质强弱规律
在氧化还原反应中,强氧化剂+强还原剂=弱氧化剂(氧化产物)+弱还原剂(还原产物),即氧化剂的氧化性比氧化产物强,还原剂的还原性比还原产物强。如由反应2FeCl3+2KI=2FeC3+2KCl+I2可知, FeCl3的氧化性比I2强,KI的还原性比FeCl2强。
一般来说,含有同种元素不同价态的物质,价态越高氧化性越强(氯的含氧酸除外),价态越低还原性越强。如氧化性:浓H2SO4,S02(H2S03),S;还原性: H2S>S>SO2。
在金属活动性顺序表中,从左到右单质的还原性逐渐减弱,阳离子(铁指Fe2+)的氧化性逐渐增强。
(3)反应先后规律
同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性较强的物质;同一还原剂与含多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性较强的物质。如:将Cl2通人物质的量浓度相同的NaBr和NaI的混合液中,C12首先与NaI反应;将过量铁粉加入到物质的量浓度相同的Fe2+、和Cu2+的混合溶液中,Fe首先与Fe3+反应。FeBr2 中通入Cl2 ,HBr和H2SO3 中通入Cl2
(4)价态归中规律
含不同价态同种元素的物质问发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价一中间价”,而不会出现交错现象。
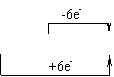
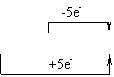
KClO3+6HCl =KCl+3Cl2+3H2O 而不是KClO3+2HCl=KCl+3Cl2+3H2O
(5)歧化反应规律
发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:
Cl2十2NaOH=NaCl十NaClO十H20
2、物质氧化性和还原性相对强弱的判断方法
(1)根据金属活动顺序进行判断
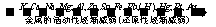
[说明]一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。如Cu2++2e→Cu远比Na+ +e→Na容易,即氧化性Cu2+>Na+,还原性Na> Cu
(2)根据非金属活动顺序进行判断
(3)根据氧化还原反应的发生规律判断
氧化还原反应发生规律可用如下式子表示:
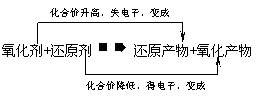
氧化性:反应物中的强氧化剂,生成物中的弱氧化剂
还原性:反应物中的强还原剂,生成物中的弱述原剂
例:已知①2FeCl3+2KI=2FeCl2+I2+2KCl
②2FeCl2+C12=2FeCl3
由①知,氧化性Fe3+>I2,由②知,氧化性C12>Fe3+,综合①②结论,可知氧化性Cl2>Fe3+
(4)根据氧化还原反应发生反应条件的不同进行判断
如:Mn02十4HCl(浓)?MnCl2+C12↑+2H20
2KMn04十16HCl(浓)=2MnCl2+5C12↑+8H2O
后者比前者容易(不需要加热),可判断氧化性 KMn04>Mn02
(5)根据被氧化或被还原的程度的不同进行判断
Cu十C12?CuCl2
2Cu+S ? Cu2S
C12可把Cu氧化到Cu(+2价),而S只能把Cu氧化到 Cu(+1价),这说明氧化性Cl2>S
(6)根据元素周期表判断
①对同一周期金属而言,从左到右其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
②对同主族的金属和非金属可按上述方法分析。
1、氧化还原反应的重要概念
练习1:判断下列那些为氧化还原反应,并说出理由
IBr + H2O = HBr + HIO
KOH+Cl2=KCl +KClO+H2O
NaH+H2O =NaOH+H2
CaO2+H2O =Ca(OH)2 +H2O2
5C2H5OH +2KMnO4+3H2SO4 →5CH3CHO +K2SO4+2MnSO4 +8H2O
氧化还原反应的实质是 ,
判断氧化还原反应的依据是 。
小结:氧化还原反应发生规律和有关概念可用如下式子表示:

练习:练习1中是氧化还原反应的,请指出氧化剂,还原剂,氧化产物,还原产物,标出电子转移的方向和数目。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com