
2.下列各组词语中,没有错别字的一组是(
)
A.修茸 眩晕 形容枯槁 锃光瓦亮 万籁俱寂
B.官邸 苍桑 蛊惑人心 晶莹剔透 长嘘短叹
C.俯瞰 蜕变 头昏脑涨 树影婆娑 桀骜不驯
D.暮蔼 喋血 形影相吊 姗姗来迟 弥足珍贵
1.下列词语中,加点字的读音完全正确的一组是( )
A.龟裂(jūn) 沉淀(diàn) 乳媪(yùn) 一丘之貉(hé)
B.栖息(qī) 联袂(mèi) 筵席(yán) 三缄其口(jiān)
C.媲美(bì) 攒(cuán)射 纤维(qiān) 风姿绰约(chuò)
D.针砭(biān) 模样(mó) 玫瑰(ɡuì) 长歌当哭(dànɡ)
3、比较H2O和H2O2
|
|
H2O |
H2O2 |
|
电子式 |
|
|
|
化学键 |
极性键 |
极性键和非极性键 |
|
分子极性 |
有 |
有 |
|
稳定性 |
 稳定 稳定2H2O 2H2↑+O2↑ |
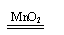 不稳定 不稳定2H2O2 2H2O+O2↑ |
|
氧化性 |
较弱(遇强还原剂反应) 2Na+2H2O==2NaOH+H2↑ |
较强(遇还原剂反应) SO2+H2O2===H2SO4 |
|
还原性 |
较弱 (遇极强氧化剂反应) 2F2+2H2O===4HF+O2 |
较强 (遇较强氧化剂反应) 2MnO4-+5H2O2+6H+==2Mn2++5O2↑+8H2O |
|
作用 |
饮用、溶剂等 |
氧化剂、漂白剂、消毒剂、脱氯剂等 |
例2:A、B、C是在中学化学中常见的三种化合物,它们各由两种无素组成,甲、乙是两种单质。这些化合物和单质之间存在如下的关系:
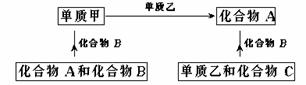
据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是(用A、B、C字母填写)。
(2)单质乙必定是(填“金属”或“非金属”),其理由是。
(3)单质乙的化学式可能是,则化合物B的化学式是。
[解析]本题不仅考查学生对非金属元素的单质及化合物性质的综合认识水平,同时也是对学生思维能力,特别是推理能力的综合检验。题目中的三问,由易到难,考查层次由低到高,着重考查学生的分析、推理、正向思维与逆向思维、从抽象思维到具体运用等能力,第(3)问又在前两问的基础上考查了学生将元素及其化合物知识进行归纳整理的能力。
(1)根据框图所示,单质甲+单质乙 化合物A,所以A中一定含乙元素;甲+B
化合物A,所以A中一定含乙元素;甲+B A+C,由于甲、乙为两不同种元素的单质,所以A中含有的乙元素一定来自于B。
A+C,由于甲、乙为两不同种元素的单质,所以A中含有的乙元素一定来自于B。
(2)由于A、B中都含有乙元素,A+B 乙+C,乙为单质。说明A、B中乙元素发生氧化还原反应之后生成零价乙元素。据同种元素不同价态间氧化还原反应的价态归中原理,可知乙元素在A、B介于0价两端,即为正价和负价。而只有非金属元素才可能表现正价和负价。所以乙为非金属元素。
乙+C,乙为单质。说明A、B中乙元素发生氧化还原反应之后生成零价乙元素。据同种元素不同价态间氧化还原反应的价态归中原理,可知乙元素在A、B介于0价两端,即为正价和负价。而只有非金属元素才可能表现正价和负价。所以乙为非金属元素。
(3)在中学化学中,显正、负价的非金属元素有Cl、S、N、C、H。在此范围中依题进行筛选。S和N2均合适。本题可排出下列关系:

[答案](1)A、B
(2)非金属,因为A+B 乙+C,且乙为单质,可知乙元素在A、B中分别呈正、负,所以乙是非金属。
乙+C,且乙为单质,可知乙元素在A、B中分别呈正、负,所以乙是非金属。
(3)S,H2S(或N2,NH3)。
2、O2和O3比较
|
|
O2 |
O3 |
|
颜色 |
无色 |
气态-淡蓝色 |
|
气味 |
无 |
刺激性特殊臭味 |
|
水溶性 |
臭氧密度比氧气的大 |
|
|
密度 |
臭氧比氧气易溶于水 |
|
|
氧化性 |
强 (不易氧化Ag、Hg等) |
极强(O3+2KI+H2O==2KOH+I2+O2) (易氧化Ag、Hg等不活泼金属) |
|
漂白性 |
无 |
有(极强氧化性-作消毒剂和脱色剂) |
|
稳定性 |
 > >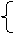 3O2
2O3 2O3===3O2 常温:缓慢 3O2
2O3 2O3===3O2 常温:缓慢加热:迅速 |
|
|
相互关系 |
臭氧和氧气是氧的同素异形体 |
1、氧族元素比较:
原子半径 O<S<Se<Te
单质氧化性 O2>S>Se>Te
单质颜色 无色 淡黄色 灰色 银白色
单质状态 气体 固体 固体 固体
氢化物稳定性 H2O>H2S>H2Se>H2Te
最高价含氧酸酸性 H2SO4>H2SeSO4>H2TeO4
2、尾气处理: 氨水  (NH4)2SO3
(NH4)2SO3 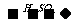 (NH4)2SO4+
SO2↑
(NH4)2SO4+
SO2↑
NH4HSO3
1、生产过程:
|
三阶段 |
SO2制取和净化 |
SO2转化为SO3 |
SO3吸收和H2SO4的生成 |
|
三方程 |
4FeS2(s)+11O2(g) = 2Fe2O3(s)+8SO2(g); △H=-3412 kJ/mol |
2SO2(g)+O2(g)  2SO3(g); 2SO3(g);△H=-196.6 kJ/mol |
SO3(g)+H2O(l)=H2SO4(l);△H=-130.3 kJ/mol |
|
三设备 |
沸腾炉 |
接触室 |
吸收塔 |
|
有 关 原 理 |
矿石粉碎,以增大矿石与空气的接触面,加快反应速率 |
逆流原理(热交换器)目的: 冷热气体流向相反,冷的SO2、O2、N2被预热,而热的SO3、SO2、O2、N2被冷却. |
逆流原理(98.3%的浓硫酸从塔顶淋下,气体由下往上,流向相反,充分接触,吸收更完全) |
|
设备中排出的气 体 |
炉气:SO2.N2.O2.矿尘(除尘).砷硒化合物(洗涤). H2O气(干燥)…… 净化气:SO2.N2.O2 |
SO2、O2、N2、SO3 |
尾气:SO2及N2、O2 不能直接排入大气中 |
|
说 明 |
矿尘.杂质:易使催化剂“中毒” H2O气:腐蚀设备、影响生产 |
反应条件-- 理论需要:低温、高压、催化剂;实际应用:400℃-500℃、常压、催化剂 |
实际用98.3%的浓硫酸吸收SO3,以免形成酸雾不利于气体三氧化硫被进一步吸收 |
4、硫酸
①稀H2SO4具有酸的一般通性,而浓H2SO4具有酸的通性外还具有三大特性:
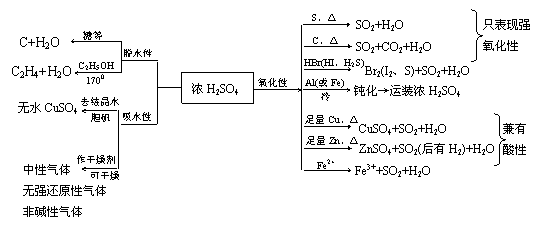
②SO42-的鉴定(干扰离子可能有:CO32-、SO32-、SiO32-、Ag+、PO43-等):
待测液 澄清液
澄清液 白色沉淀(说明待测液中含有SO42-离子)
白色沉淀(说明待测液中含有SO42-离子)
③硫酸的用途:制过磷酸钙、硫酸铵、硫酸铜、硫酸亚铁、医药、炸药,用于铅蓄电池,作干燥剂、制挥发性酸、作脱水剂和催化剂等。
3、硫的氧化物
(1)二氧化硫:
①SO2是无色而有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
②SO2是酸性氧化物,能跟水反应生成亚硫酸,亚硫酸是中强酸。
③SO2有强还原性 常见氧化剂(见上)均可与SO2发生氧化一还原反应
如:SO2 + Cl 2 +2H2O == H2SO4 + 2HCl
④SO2也有一定的氧化性 2H2S + SO2 == 3S↓ +2H2O
⑤SO2具有漂白性,能跟有色有机化合物生成无色物质(可逆、非氧化还原反应)
⑥实验室制法:Na2SO3 + H2SO4(浓) == Na2SO3 + H2O +SO2↑
或Cu + 2H2SO4(浓) === CuSO4 + 2H2O + SO2↑
(2)三氧化硫:是一种没有颜色易挥发的晶体;具有酸性氧化物的通性,遇水剧烈反应生成硫酸并放出大量的热。
(3)比较SO2与CO2、SO3
|
|
SO2 |
CO2 |
SO3 |
|
主要物性 |
无色、有刺激性气体、易液化易溶于水(1:40) |
无色、无气味气体能溶于水(1:1) |
无色固体.熔点(16.8℃) |
|
与水反应 |
 SO2+H2O H2SO3 中强酸 SO2+H2O H2SO3 中强酸 |
 CO2+H2O H2CO2
弱酸 CO2+H2O H2CO2
弱酸 |
SO3+H2O==H2SO4(强酸) |
|
与碱反应 |
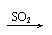 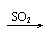 Ca(OH)2 CaSO3↓ Ca(HSO3)2 清液 白 清液 |
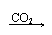 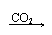 Ca(OH)2 CaCO3↓ Ca(HCO3)2 清液 白↓ 清液 |
SO3+Ca(OH)2==CaSO4(微溶) |
|
紫色石蕊 |
变红 |
变红 |
变红 |
|
品红 |
褪色 |
不褪色 |
不褪色 |
|
鉴定存在 |
能使品红褪色 又能使清石灰变浑浊 |
不能使品红褪色 但能使清石灰水变浑浊 |
|
|
氧化性 |
SO2+2H2S=2S↓+2H2O |
CO2+2Mg = 2MgO+C CO2+C = 2CO |
|
|
还原性 |
有 |
无 |
|
|
与Na2O2作用 |
Na2O2+SO2==Na2SO4 |
2Na2O2+2CO2==2Na2CO3+O2 |
2Na2O2+2SO3==2NaSO4+O2↑ |
(4)酸雨的形成和防治
酸雨的形成是一个十分复杂的大气化学和大气物理过程。酸雨中含有硫酸和硝酸等酸性物质,其中又以硫酸为主。从污染源排放出来的SO2、NOx(NO、NO2)是酸雨形成的主要起始物,因为大气中的SO2在光照、烟尘中的金属氧化物等的作用下,经氧化、溶于水等方式形成H2SO4,而NO被空气中氧气氧化为NO2,NO2直接溶于水形成HNO3,造成了雨水pH值降低,便形成了酸雨。
硫酸型酸雨的形成过程为:气相反应:2SO2+O2=2SO3、SO3+H2O=H2SO4;液相反应:SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4。总反应: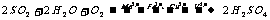
硝酸型酸雨的形成过程为:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO。
引起硫酸型酸雨的SO2人为排放主要是化石燃料的燃烧、工业尾气的排放、土法炼硫等。引起硝酸型酸雨的NOx人为排放主要是机动车尾气排放。
酸雨危害:①直接引起人的呼吸系统疾病;②使土壤酸化,损坏森林;③腐蚀建筑结构、工业装备,电信电缆等。
酸雨防治与各种脱硫技术:要防治酸雨的污染,最根本的途径是减少人为的污染物排放。因此研究煤炭中硫资源的综合开发与利用、采取排烟脱硫技术回收二氧化硫、寻找替代能源、城市煤气化、提高燃煤效率等都是防止和治理酸雨的有效途径。目前比较成熟的方法是各种脱硫技术的应用。
在含硫矿物燃料中加生石灰,及时吸收燃烧过程中产生的SO2,这种方法称为“钙基固硫”,其反应方程式为:SO2+CaO=CaSO3,2CaSO3+O2=2CaSO4;也可采用烟气脱硫技术,用石灰浆液或石灰石在烟气吸收塔内循环,吸收烟气中的SO2,其反应方程式为:SO2+Ca(OH)2=CaSO3+H2O,SO2+CaCO3=CaSO3+CO2,2CaSO3+O2=2CaSO4。在冶金工业的烟道废气中,常混有大量的SO2和CO,它们都是大气的污染物,在773K和催化剂(铝矾土)的作用下,使二者反应可收回大量的硫黄,其反应原理为:SO2+2CO==S+CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com