
84. The owner of the cinema needed to make a lot of improvements and employ more people to keep it running, ______ meant spending tents of thousands of pounds.
A. who B. that C as D. which
83.Look out! Don’t get too close to the house _____ roof is under repair.
A. whose B. which C. of which D. that
82. We saw several natives advancing towards our party, and one of them came up to us, ______ we gave some bells and glasses.
A. to which B to whom C. with whom D. with which
81. She was educated at Beijing University, _____ she went on to have her advanced study abroad.
A. after that B. from that C. from which D. after which
80.-Do you have anything to say for yourselves?
---Yes , there’s one point ____ we must insist on.
A. why B. where C. how D./
79. We are just trying to reach a point ______ both sides will sit down together and talk.
A. where B. that C. when D. which
78. Women _______ drink more than two cups of coffee a day have a greater chance of having heart disease than those ______ don’t.
A. who, / B. / , who C. who, who D./, /
3、化学性质--硫原子最外层6个电子,较易得电子,表现较强的氧化性。
(1)与金属反应 Na+S--Na2S (剧烈反应并发生爆炸)
(Na+S--Na2Sx)
 Al+S △ Al2S2(制取Al2S3的唯一途径)
Al+S △ Al2S2(制取Al2S3的唯一途径)
 Fe+S △ FeS(黑色)
Fe+S △ FeS(黑色)
思考:①21g铁粉跟8g硫粉混合加热,冷却后将所得固体溶于足量盐酸,在标准状况下可得气体多少升?
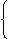 (据Fe-FeS-H2S↑可知,不论谁过量,有1molFe,必须生成1mol气体,则所得气
(据Fe-FeS-H2S↑可知,不论谁过量,有1molFe,必须生成1mol气体,则所得气
Fe-H2↑
体体积为: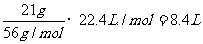 )
)
②若为21g硫粉和8g铁粉混合,在空气中加热,冷却后,所得固体质量为多少克?
 (解:Fe + S △ FeS
(解:Fe + S △ FeS
56g 32g
8g 21g
则硫过量,但由于在空气中加热,过量的硫与O2反应生成了SO2气体,因此,所得固体只能为FeS。其质量为: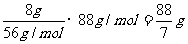 )
)
 2Cu + S △ Cu2S(黑色)
2Cu + S △ Cu2S(黑色)
思考:①进行该实验时,将硫固体加热熔化至变成蒸气,再将光亮的铜丝放入硫蒸气中发生反应。实验时间较长,能否改成将铜丝加热后插入硫粉中?
 (不能,若将铜丝在酒精灯上加热,Cu+O2 △ CuO(黑色),铜转化为氧化铜,反应将不再发生)
(不能,若将铜丝在酒精灯上加热,Cu+O2 △ CuO(黑色),铜转化为氧化铜,反应将不再发生)
②对铜,铁与硫的反应产物进行分析,硫与Cl2的氧化性哪个更强?理由是什么?
(氯气更强,因为S只将铜,铁氧化到低价,而氯气则将它们氧化到高价)
 (2)与非金属的反应 S+O2 点燃 SO2
(2)与非金属的反应 S+O2 点燃 SO2
 思考:已知2SO2+O2 2SO3+Q(Q>0)反应温度对SO3的产率影响更大。硫在空气中和纯氧中燃烧,均能产生少量SO3,问在空气中或纯氧中燃烧哪个产生更多的SO3?为什么?
思考:已知2SO2+O2 2SO3+Q(Q>0)反应温度对SO3的产率影响更大。硫在空气中和纯氧中燃烧,均能产生少量SO3,问在空气中或纯氧中燃烧哪个产生更多的SO3?为什么?
(空气中。因为纯氧中燃烧,尽管O2浓度大,但产生的热量更多,而在空气中燃烧,速率较小,产生的热量能及时分散到空气中)
 S+H2 H2S(说明硫化氢不稳定)
S+H2 H2S(说明硫化氢不稳定)
(3)与化合物的反应


 S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
S+2H2SO4(浓) △ 2SO2↑+2H2O
 S+NaOH △ Na2S+Na2SO3+H2O
S+NaOH △ Na2S+Na2SO3+H2O
思考:由硫能溶于热碱溶液可知,用热碱溶液可洗去试管壁上的硫,实验室为何常用热Ca (OH)2溶液而不用热NaOH溶液除去试管内的硫?(因NaOH碱性强,腐蚀玻璃)
S + Na2S = Na2Sx
S + Na2SO3 △ Na2S2O3
例1、硫与热强碱溶液可生成S2-和SO32-;生成物继续与硫作用得Sz2-和S2O32-。过滤后除去过量硫,向滤液中加入一定量的强碱后,再适入足量的SO2,SO2与Sz2-也完全转化为S2O32-。问:
(1)S+SO2+OH-完全转化为S2O32-的离子方程式____________________
(2)amolS最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
(3)若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为
_________。
 解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①
解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①


 S2-+(x+1)S Sx2- ………………②
S2-+(x+1)S Sx2- ………………②
SO32-+S △ S2O32- ……………………③
由①②③迭加得:(2x+2)S+6OH- = 2Sx2-+S2O32-+3H2O …………④
SO2+Sx2-+OH---S2O32-+H2O ………………⑤
由④⑤迭加得:S+SO2+2OH-=S2O32-+H2O …………………………⑥
答:第(1)问时,实质不必要这么繁的过程,因Sx2-、SO32-均为中间产物,只要抓住反应物为S和SO2及OH-,生成物为S2O32-和水即可得反应⑥。
由⑥式可知每有1mol硫需1molSO2和2molOH-,则SO2和OH-分别为a、2amol。
(2)由④式可知 x=
x=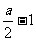
例2、工业上将硫黄混入Na2SO3溶液中共热至沸可制取Na2S2O3。制备Na2S2O3的另一种方法是把SO2通入Na2S和Na2CO3的混合液中,在反应过程中,先生成黄色沉淀,其量逐渐增多,然后又逐渐减少。当形成无色透明溶液时,反应完成:
(1)写出用上述反应制备Na2S2O3的化学方程式
①_________________________ ②____________________
③_________________________ ④Na2SO3+S △ Na2S2O3
(2)原料中Na2CO3、Na2S、SO2的物质的量比最佳是___________________。
(3)若SO2过量,则又会有黄色沉淀出现,其原因是(用离子方程式表示)______________。
解析:由于SO2溶于水生成H2SO3,而H2SO3是中强酸,其酸性比H3PO4还要强。则
(1)①SO2+H2O+Na2S= Na2SO3+H2S
②SO2+Na2CO3= Na2CO3+CO2
③SO2+2H2S= 3S↓+2H2O
(2)要求三种物质的最佳配比,必须牢牢抓住关键的反应式④,其反应物为S和
Na2SO3,S由反应③生成,Na2SO3由反应①②形成,由反应③可知每生成3molS需2molH2S和1molSO2,则反应④可改为3Na2SO3+3S=3Na2S2O3,而生成2molH2S则需2molNa2S和2molSO2,同时生成2mol Na2SO3,现还差1mol Na2SO3,由反应②提供。则Na2CO3、Na2S、SO2的最佳物质的量比为1:2:4。
(3)若SO2过量,又生成3H2SO3,H2SO3+S2O32- H2S2O3+SO32-,H2S2O3极不稳定,H2S2O3→H2O+S+SO2,SO2与SO32-又能继续转化为HSO3-,因此,该反应的离子方程式为:
H2S2O3+SO32-,H2S2O3极不稳定,H2S2O3→H2O+S+SO2,SO2与SO32-又能继续转化为HSO3-,因此,该反应的离子方程式为:
SO2+H2O+S2O32-=S↓+2HSO3-

 2e 10e
2e 10e
 S + 3C +2KNO3
点燃 K2S+N2↑+3CO2(黑火药爆炸)
S + 3C +2KNO3
点燃 K2S+N2↑+3CO2(黑火药爆炸)
橡胶的硫化(化学变化,将橡胶从线型结构转化为体型网状结构,增强橡胶的强度和弹性)
2、物理性质:硫有多种同素异开体。如单斜硫、斜方硫、弹性硫等。不同温度硫分子含硫原子数不同、常温是S8、高温蒸气主要是S2。常温为淡黄色晶体(淡黄色固体有:Na2O2、AgBr、黄铁矿、T、N、T等)。
注意:①在溶液中通过化学反应生成少量硫时,有时称乳白色。
②硫的溶解性:不溶于水,微溶于酒精,易溶于CS2。因此用物理方法洗去试管壁上的硫,只能用CS2作溶剂。
1、 游离态--自然界存在于火山喷口、地壳岩层。人类在远古时代发现并使用硫。
游离态--自然界存在于火山喷口、地壳岩层。人类在远古时代发现并使用硫。
存在
化合态--存在形式有:FeS2(非盐)、CuFeS2(复盐)、石膏、芒硝、煤和石油
中含少量硫--污染大气物主要来源。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com