
6.(河南周口09高三期末考试)观察下列模型并结合有关信息,判断有关说法正确的是
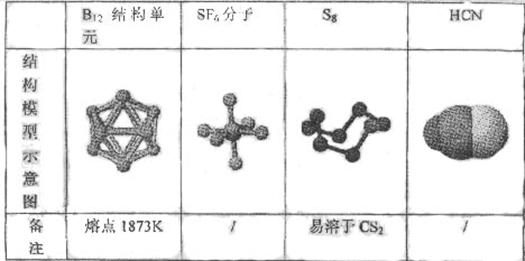
A. 单质硼属原子晶体.结构单元中含有30个B-B键.含20个正三角形
B. SF6是由极性键构成的极性分子 。
C. 固态硫S。属于原子晶体
D. HCN的结构式为H∶C∶∶N
5.(东北师大附中09高三年级“三年磨一剑”第四次摸底考试)下面图像是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的是
①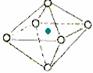 ②
② 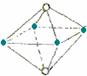 ③
③ 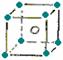 ④
④ 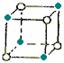
A.①和④ B.②和③ C.①和③ D.只有①
4.(河北正定中学2009届高三第四次月考)若不断地升高温度,实现"雪花→水→水蒸气→氧气和氢气"的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是
A.氢键;分子间作用力;非极性键 B.氢键;氢键;极性键
C.氢键;极性键;分子间作用力 D.分子间作用力;氢键;非极性键
3.(黑龙江哈尔滨三中2008年12月高三月考考试试卷)下列有关物质的性质比较,不正确的是
A.熔点:Li>Cs B.还原性:F>I
C.热稳定性:H2O>H2S D.酸性:H3PO4>H3AsO4
2.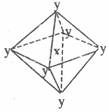 (2009年阳泉市十五中学高三第二次理综考试化学部分)在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为:
(2009年阳泉市十五中学高三第二次理综考试化学部分)在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为:
A.NaCl B.CsCl C.CO2 D.SiO2
1.(2009年天津市滨海新区五所重点学校高三毕业班联考)下列性质比较正确的是( )
A.离子半径: K+>Cl->Na+>F- B.酸性: HClO4>H3PO4>H2S>H3AlO3
C.还原性: Cl->Br->I->S2- D.沸点: 甲醛>甲醇>甲烷
22.(福建08-09学年福州三中高三理科综合试卷)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10-2)
__________________________________________________________________。
(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
|
KMnO4酸性溶液 的浓度 / mol·L-1 |
溶液褪色所需时间
t / min |
||
|
第1次 |
第2次 |
第3次 |
|
|
0.01 |
14 |
13 |
11 |
|
0.001 |
6 |
7 |
7 |
① 计算用0.001 mol·L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前
后溶液的体积变化,写出计算过程)
② 若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:
_________________________________________________________
[答案](1)2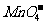 + 5H2C2O4 + 6H+
= 2Mn2+ + 10CO2↑+ 8H2O (2)4
+ 5H2C2O4 + 6H+
= 2Mn2+ + 10CO2↑+ 8H2O (2)4
(3)①
反应开始时:c(KMnO4)=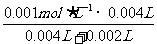 =0.00067
mol·L-1
=0.00067
mol·L-1
反应时间: =
=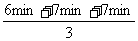 =6.7min
=6.7min
KMnO4的平均反应速率:
ν(KMnO4)= =
=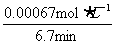 =1×10-4
mol·L-1·min-1
=1×10-4
mol·L-1·min-1
②
否(或:不可行) 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应
21.(福建厦门双十中学09届高三第二学期开学考)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:


请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)操作II必须用到的仪器是 。(填编号)
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式 ,加入氨水要过量的原因是 。
(3)洗涤沉淀的操作是 ;检验沉淀是否已经洗涤干净的操作是
。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量
其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
。
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 。
[答案](1)250mL容量瓶、胶头滴管 D
(2)2Fe 2+ + Br2 = 2Fe 3+ + 2Br- 使Fe3+充分沉淀
(3)往过滤器中加入蒸馏水使之稍浸没沉淀,让水自然滤下,反复操作2~3次。
取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净(合理的答案均可得分) (4)再次加热冷却并称量,直至两次质量差小于0.1g
(5)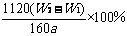 固体加热时未充分反应变为 Fe2O3
固体加热时未充分反应变为 Fe2O3
20.(漳州市芗城中学2009年5月份月模拟)
Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如右图所示,其中X、Y、Z三种元素的质子数之和为21。
(1)氢元素与Z形成原子个数比为1∶1的化合物,其结构式为 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是 (用离子方程式表示) ;该溶液中各种离子浓度由大到小的顺序为
。
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
,反应中每转移8mol 电子,消耗的还原剂质量为 g
Ⅱ.为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ·moL-1
2H2(g)+O2(g)===2H2O(g);ΔH=-483.6KJ·moL-1
H2O (g)===H2O(l);ΔH=-44.0KJ·moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
Ⅲ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:
CO+ H2O(g)=== CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
Ⅳ.H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。
[答案]Ⅰ.(1)H-O-O-H
(2)NH4+
+ H2O 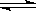 NH3·H2O + H+
NH3·H2O + H+
c (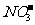 )>
c (
)>
c (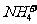 )
> c (H+) > c (
)
> c (H+) > c (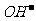 )
)
(3)C + 4HNO3(浓)△ CO2↑ + 4NO2↑ + 2H2O 24
Ⅱ.CO(g)+H2O(g)===CO2(g)+H2(g);ΔH=-41.2KJ·moL-1 (其它合理答案也可给分)
Ⅲ.83.3%
Ⅳ.H2+2OH--2e-===2H2O
19.(2008广东佛山二模)生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_________
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为________________ (不用写反应条件),原子利用率是_________ 。
(3)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗__________mol氧气。
②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_____________。
③下列说法正确的是__________。(选填字母)
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯
[答案](1)小
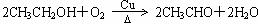 (2)CH2=CH2 + H2O → CH3CH2OH ,100%
(2)CH2=CH2 + H2O → CH3CH2OH ,100%
(3)①3 ② ③BCD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com