
1. 推动上千吨的火箭和进行长距离的太空飞行的巨大能量是从哪里来的?化学反应立下神功。火箭使用的燃料是偏二甲肼[(CH3)2NNH2],火箭升空时发生的化学反应为:
C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑。下列有关该反应的说法正确的是
A.偏二甲肼既是氧化剂又是还原剂
B.该反应进行时只有放热过程没有吸热过程
C.该反应中氮元素的化合价升高
D.该反应中每生成1mol CO2转移8mol电子
17. 写出下列反应过程的离子方程式:
①在NaOH和NaAlO2溶液中滴加盐酸至过量
__________________________________________________________________________
②在NaOH和Na2CO3的混合溶液中滴加盐酸至过量
__________________________________________________________________________
③在Ba(OH)2溶液中通入过量SO2_______________________________________________
④在NH4HCO3溶液中加入足量Ba(OH)2溶液_______________________________________________
16. 由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、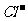 、NH4+、Mg2+、Ba2+、
、NH4+、Mg2+、Ba2+、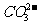 、
、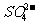 -。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
-。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 实验内容 实验结果
1) 加AgNO3溶液 有白色沉淀生成
2) 加足量NaOH溶液并加热 收集到气体1.12L(已折算成标准状况下的体积)
3) 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 第一次称量读数为6. 27g,第二次称量读数为2.33g
试回答下列问题:
(1)根据实验1对C1-是否存在的判断是 (填"一定存在"、"一定不存在
"或"不能确定");根据实验1-3判断混合物中一定不存在的离子是
。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 物质的量浓度(mol·L-1)
(3)试确定K+是否存在? ,判断的理由是
。
15. (1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
该反应中还原产物是______;若反应过程中转移了0.3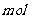 电子,则氧化产物的质量是______
电子,则氧化产物的质量是______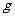 。
。
(2)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式。
① 当 a / b =1时____________________________________________;
② 当a / b≥3/2时____________________________________________。
③ (3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3
+H2O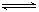 Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O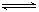 NH4+ + OH_
NH4+ + OH_
(A)已知B(OH)3是一元弱酸,试写出其电离方程式__________________________________
(B)N2H4是二元弱碱,试写出其第二步电离方程式____________ ________________
14. 某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、 、
、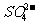 、
、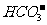 、
、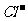 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③ 取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④ 取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失
请回答下列问题:
⑴在实验 ① 中,下图所示的操作中正确的是___________(填代号)。

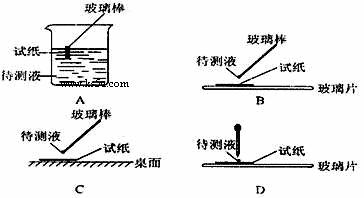
⑵根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是______________________。
⑶写出与②③两个实验有关的离子方程式:
②_____________________________________________________________
③_____________________________________________________________
13. 现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1) 写出化学式:A___________ B___________ D_________
(2) E溶液呈酸性的原因是:(用离子方程式表示)_______________________________
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(4 )在100mL0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 mol
12. 有一元色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
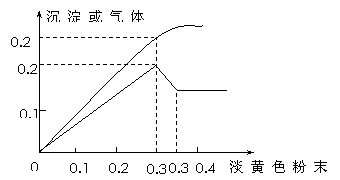
(1)溶液中肯定没有_____________离子。
(2)溶液中离子的物质的量之比为_________________________________。
(3)①淡黄色粉末与水反应的化学方程式为__________________________。
②沉淀部分减少时的离子方程式为____________________________________。
11、有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO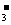 、SO
、SO 、Cl-、I-、HCO
、Cl-、I-、HCO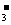 ,取该溶液实验如下:
,取该溶液实验如下:
|
实验步骤 |
实验现象 |
|
①取少量该溶液,加几滴甲基橙 |
溶液变红色 |
|
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,后在空气中又变成红棕色 |
|
③取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
|
⑤取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是________ _ ________
。
10. 某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
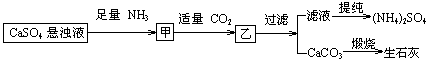
下列推断不合理的是 ( )
A.往甲中通适量CO2有利于(NH4)2SO4生成
B.生成1mol(NH4)2SO4至少消耗2 NH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
9. 下列反应的离子方程式正确的是 ( )
A.铜片插入氯化铁溶液中 Cu+Fe3+=Cu2++Fe2+
B.电解饱和食盐水 2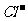 +2H+
+2H+ H2↑+C12↑
H2↑+C12↑
C.向溴化亚铁溶液中通入过量的氯气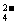 2Fe2++Cl2=2Fe3++2
2Fe2++Cl2=2Fe3++2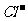
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2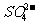 +2Ba2++5
+2Ba2++5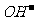 =AlO2-+2BaSO4↓+NH3·H2O+2H2O
=AlO2-+2BaSO4↓+NH3·H2O+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com