
14.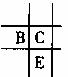 已知aA、bB、cC、dD、eE均为短周期元素,且原子序数依次增大。已知A、D同主族,A与其他元素均不同周期,B、C、E三种元素在周期表中的位置如图所示,且BC对应的单质在常温下为无色气体。请回答下列问题:
已知aA、bB、cC、dD、eE均为短周期元素,且原子序数依次增大。已知A、D同主族,A与其他元素均不同周期,B、C、E三种元素在周期表中的位置如图所示,且BC对应的单质在常温下为无色气体。请回答下列问题:
(1)A、B形成的四原子核化合物属于__________(填“极性”或“非极性”)分子,其易液化,原因是___________________________。
(2)由A、C两元素组成的三种10电子微粒是___________、____________、_______________
(3)甲是由A、C两元素形成的常见四原子核化合物,乙是由A、C、E形成的六原子
核化合物,乙的水溶液和甲的水溶液相互反应的化学方程式为
_____________________________。
(4)从五种元素中任选三种元素,组成化合物X和Y,在下列表格中按要求填写相应的化学式(每空只写一种即可)。
|
X
pH>7(25℃) |
Y
pH<7(25℃) |
|
抑制水的电离:____________________ |
抑制水的电离:____________________ |
|
促进水的电离:____________________ |
促进水的电离:____________________ |
[答案](1)极性;分子间存在氢键(2)H2O;OH-;H3O+(3)H2O2+H2SO3=H2SO4+H2O
(4)
|
X
pH>7(25℃) |
Y
pH<7(25℃) |
|
NaOH |
H2SO4 |
|
NaHS |
NH4NO3 |
[解析]A与其他元素不同周期且原子序数最小,A为H,与之同主族元素D为Na,根据B、C、E在周期表中位置以及B、C的颜色状态,B为N,C为O,因此推断E为S。
所以A、B形成的四原子核化合物为NH3,极性分子,由于分子间存在氢键,沸点较高,容易液化。A、C组成的3种10电子微粒为H2O、OH-、H3O+。其中A和C组成的4原子核化合物为H2O2,具有氧化性,A、C、E形成的六原子核化合物具有还原性的为H2SO3,二者反应生成H2SO4。任选三种元素组成化合物,其中抑制水电离的为酸或者碱,如NaOH,H2SO4、HNO3等,促进水的电离的化合物为能水解的盐,如Na2SO3、NaHS、NH4NO3等。
13. 有关元素A、B、C、D、E的信息如下
|
元素 |
有关信息 |
|
A |
元素主要化合价为-2,A的一种氢化物可用于实验室制取A的单质 |
|
B |
所在主族序数与所在周期序数之差为4 |
|
C |
原子中含10个P电子 |
|
D |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
|
E |
生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
请回答下列问题:
(1)元素A-E中两种元素组成的化合物使品红溶液褪色的物质的化学式为
_____________
(2)E元素与B元素可形成EB2和EB3两种化合物,下列说法正确的是(填序号)________。
①保存EB2溶液时,需向溶液中加入少量E单质
②EB2只能通过置换反应生成,EB3只能通过化合反应生成
③铜片、碳棒和EB3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2C的水溶液中各粒子的浓度关系,如c(C2-)=______________。
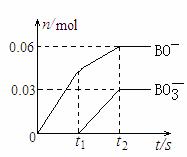
(4)将一定量的B单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含B元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。该苛性钾溶液中KOH的质量是___________,该反应中转移电子的物质的量是_________。
(5)工业上冶炼E单质的化学方程式为__________________________________
[答案](1)SO2、Na2O2
(2)①③
(3)c(S2-)= 1/2[c(Na+)+c(H+)- c(HS-)-c(OH-)]或c(S2-)= 1/2c(Na+)- c(HS-)-c(H2S)(其它合理答案也可)
(4)16.8g 0.21mol
(5)Fe2O3+3CO 3CO2+2Fe
3CO2+2Fe
[解析]根据题给信息A为氧元素,实验室可以用双氧水来制备氧气;所在主族序数与所在周期序数之差为4,B元素为氧或者氯,因为A为氧,所以B为氯元素;C元素原子中含10个P电子,P电子一定为2p63p4,C元素为硫;最高价氧化物对应水化物,能电离出电子数相等的阴、阳离子,由于Mg(OH)2、Al(OH)3难溶,所以该物质为NaOH,D为钠元素;E有两种氯化物,相对原子质量相差35.5,E有变价,为Fe元素。
(1)漂白性物质包括化合漂白和氧化性漂白等,这几种元素中的两种元素形成的具有漂白性的物质有SO2、Na2O2
(2)FeCl2可以通过化合反应制得,如:2FeCl3+Fe=3FeCl2,FeCl3可以通过分解反应制得如2Fe(OH)3=Fe2O3+3H2O;淀粉碘化钾溶液中滴加几滴FeCl3的浓溶液,溶液呈蓝色,苯酚溶液中滴加几滴FeCl3的浓溶液,溶液显紫色,正确的说法为①③。
(3)在Na2S溶液中,根据电荷守恒有:2c(S2-)+ c(HS-)+c(OH-)= c(Na+)+c(H+),根据物料守恒有:c(Na+) = 2 [c(S2-)+c(HS-)+c(H2S)],变形即可。
(4)根据得失电子守恒,Cl2与KOH反应生成KClO、KClO3外,还有KCl生成,依据ClO-和ClO3-的物质的量配平方程式,有
5Cl2+10KOH=7KCl+2KClO+KClO3+5H2O,转移电子0.03*7=0.21mol,反应消耗KOH的质量为0.03*10*56=16.8g。
(5)工业炼铁是用CO还原铁矿石制得
12.A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式
、 。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和碳化钙与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+
时,反应中电子转移为4 mol,写出该反应的离子方程式
。
[答案]
(1)HNO3、NH4NO3(其他合理答案均给分) (各1分,共2分)
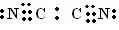 (2) (2分)
(2) (2分)
(3)Na3N + 4HCl = 3NaCl+NH4Cl(2分)
(4)① C2H6(g)+7/2 O2(g) = 2CO2 (g) + 3H2O (l) ;△H = 一1559 kJ / mol(2分)
或 2C2H6(g)+7 O2(g) = 4CO2 (g) + 6H2O (l) ;△H = 一3118 kJ / mol
② 2 Fe2+ + 6 I- + 4 H2O2 + 8 H+ = 2 Fe3+ + 3 I2 + 8 H2O(3分)
11.A、B、C、D、E均为短周期元素,且原子序数依次递增。A、E同主族,B、D同周期,且B和D最外层电子数之和为10;A与D可形成,A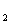 D、A
D、A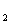 D
D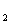 共价化合物。请回答下列问题。
共价化合物。请回答下列问题。
(1)D位于周期表第_______周期,_________族;
(2)E离子的结构示意图为_________________;与E同周期的元素中,金属性最弱的金属元素名称是_________,最稳定的气态氢化物的化学式为_________;
(3)C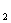 的电子式为______,B与D通常能形成______晶体,在E
的电子式为______,B与D通常能形成______晶体,在E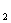 D
D 中含有的化学键有_;
中含有的化学键有_;
(4)由A、B、C、D四种元素组成的离子化合物的化学式为(写出一种即可)_______________,组成的共价化合物的结构简式为(写出一种即可)___________________;
[答案]
(1)2
ⅣA 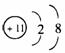
(2)铝 HCl
(3)  分子 离子键、非极性键(或共价键)
分子 离子键、非极性键(或共价键)
(4)NH HCO
HCO [或(NH
[或(NH )
) CO
CO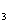 ] NH
] NH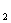 -CH
-CH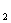 -COOH(或尿素、其他氨基酸等)
-COOH(或尿素、其他氨基酸等)
10. 通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A: ; B: ;C: ;D: 。
(2)写出A、B、E三种微粒反应的离子方程式: 。
[答案](1)H2O NH3 NH4+ OH-
(2)Al3++3NH3+3H2O=Al(OH)3↓+3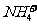 ,
,
Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4
[解析]常见核外电子总数为10个电子的微粒共有15种。阳离子有:Na+、Mg2+、Al3+、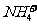 、H3O+;阴离子有:N3-、O2-、
、H3O+;阴离子有:N3-、O2-、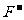 、
、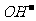 、NH2-;分子有:Ne、HF、H2O、NH3、CH4。根据题意知B溶于A后所得的物质可电离出阳离子C和阴离子D,可知A为H2O,B为NH3,氨气溶于水生成的一水合氨电离出
、NH2-;分子有:Ne、HF、H2O、NH3、CH4。根据题意知B溶于A后所得的物质可电离出阳离子C和阴离子D,可知A为H2O,B为NH3,氨气溶于水生成的一水合氨电离出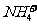 和
和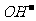 离子。第(2)问带有一定的开放性,一种10电子的阳离子能和氨水反应生成沉淀和铵根离子,这种阳离子可以是Mg2+也可以是Al3+
离子。第(2)问带有一定的开放性,一种10电子的阳离子能和氨水反应生成沉淀和铵根离子,这种阳离子可以是Mg2+也可以是Al3+
9. 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:[MxFey(CN)z],研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子晶胞结构如图示,下列说法正确的是
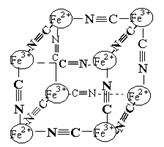
A.该晶体是原子晶体
B.M的离子位于上述晶胞的面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+的占总体心的百分比)
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
[答案]C、D 这是一道非常新颖的结合有机的晶体题。首先根据结构粒子是离子,可确定该晶体为离子晶体,并非原子晶体。观察阴离子晶胞可知,Fe2+、Fe3+共占据8个顶点,平均分摊到4×1/8=1/2个,CN-在棱上,分摊到12×1/4=3个,再根据阴阳离子所带电荷,可确定晶胞中阴离子组成为:[Fe(CN)3]0.5-,扩大两倍(相当于两个阴离子晶胞)得[Fe2(CN)6]-,显见,所对应的阳离子只能为+1价,形成M2[Fe2(CN)6],即两个晶胞共有1个M+阳离子,根据晶胞知识,其只能位于体心,且每两个晶胞中一个有M+,另一个必无,即空缺率为50%。故答案应选C和D
8. 元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有
A. 能与水反应 B. 能与氢氧化钠反应
C. 能与硫酸反应 D. 能与碳酸钠反应
[答案] BD
7.右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
|
|
|
||
|
X |
|
|
|
|
Y |
Z |
|
|
|
|
|
W |
|
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①②
C.①②③ D.①②③④
[答案]C
6.(07北京理综)X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1︰1
D.X2Y可能是离子化合物,也可能是共价化合物
[答案]D
5. 表中①-⑥为短周期元素及相应部分原子半径的数据:
|
元 素 性 质 |
元 素 编 号
|
|||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
原子半径(nm) |
a |
0.075 |
b |
0.110 |
c |
d |
|
最 高 化 合 价 |
+6 |
+5 |
|
+5 |
|
+7 |
|
最 低 化 合 价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
下列说法正确的是( )
A. 元素①的最外层电子排布为2S22P4
B. 元素②氢化物与元素⑥氢化物之间反应形成化合物中只有极性键
C. 原子半径:a>d>b>c
D. 非金属性:元素⑤>元素④>元素①
[答案]C
[解析]先从化合价角度分析,最高正价为最外层电子数,最低价的绝对值为8减最外层电子数。元素①和元素③同在ⅥA族,由于O无最高正价,可确定元素①为S和元素③为O元素;元素②和元素④同在ⅤA族,半径大小②< ④,马上确定元素②为N元素④为P元素;元素①的最外层电子排布为3S23P4;NH3与HCl生成NH4Cl中含有离子键和极性键;原子半径大小应为S>Cl>O>F,即a>d>b>c;非金属性:元素⑤>元素①>元素④,即F>S>P。选C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com