
8. 在一定条件下,将3 molA和1
molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应: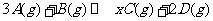 。
2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L
。
2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L 下列判断正确的是( )
下列判断正确的是( )
A.平衡常数约为0.3
B.B的转化率为60%
C.A的平均反应速率为0.3mol·(L·min)

D.若混合气体的密度不变则表明该反应达到平衡状态
7. 对于反应2A(g)+B(g)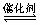 2C(g),△H =- a kJ/mol ,(a>0)下列判断正确的是
2C(g),△H =- a kJ/mol ,(a>0)下列判断正确的是
A.2体积A和足量B反应,必定生成2体积C,放出a KJ热量
B.若反应容器的容积和温度不变,增大压强,平衡必定向右移动
C.平衡时,A消耗速度必定等于B生成速度的两倍
D.平衡时,A浓度必定等于B浓度的两倍
6. 高温下,某反应达平衡,平街常数
高温下,某反应达平衡,平街常数 恒容时,温度升高.H2浓度减小。下列说法正确的是
恒容时,温度升高.H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为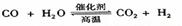
5. 某可逆反应 ,若按下列两种配比
,若按下列两种配比
(1)0.8molA 1.2molB 1.2molC 2.4molD
(2)1.4molA 2.1molB 0.6molC 1.2molD
将它们放入一容积不变的密闭容器中,保持温度不变,达平衡后C的质量分数仍相等,则化学反应方程式中x的值为( )
A、2 B、3 C、4 D、1
4. 在一定温度下,将CO和水蒸汽各1mol放在密闭容器中反应:
 ,达平衡后测得
,达平衡后测得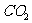 为0.6mol,再通入4mol水蒸汽,达新的平衡后,
为0.6mol,再通入4mol水蒸汽,达新的平衡后,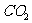 物质的量( )
物质的量( )
A等于0.6mol B等于1mol
C大于0.6mol,小于1mol D大于1mol
3. 和
和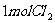 充入一容积不变的密闭容器中,在一定条件下反应
充入一容积不变的密闭容器中,在一定条件下反应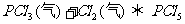 (气)达平衡时,
(气)达平衡时, 为0.4mol,此时若移走
为0.4mol,此时若移走 和
和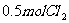 在相同温度下达平衡时
在相同温度下达平衡时 的物质的量是( )
的物质的量是( )
A 0.4mol B0.2mol
C小于0.2mol D大于0.2mol而小于0.4mol
2. 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol,用反应物浓度的减少来表示该反应的速率可能为( )
A
B
C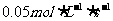
D
1. 已知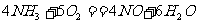 若反应速率分别用
若反应速率分别用 、
、
 表示,则正确的关系是( )
表示,则正确的关系是( )


16. U、V、W、X、Y为短周期元素,且原子半径依次增大,U、V同主族,V、W、X、Y处于同周期,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,Z为血红蛋白中所必需的金属元素,且U、W、Z分别能与氧元素形成U203、W2O3、Z2O3。
回答下列问题:
(1)U的气态氢化物分子的电子式为 。盐A中阳离子的检验方法是
。
(2)1molV的最高价氧化物对应的水化物与3 molKOH恰好完全反应,其产物的化学式为 。
(3)W的单质与Y的最高价氧化物对应的水化物的溶液反应,其离子方程式是 .
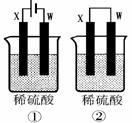
(4)如下图所示的两个实验装置中,溶液的体积均为100mL,开始时硫酸溶液的浓度均为0.055mol/L,工作一段时间后。测得导线中均通过0.01mol电子(若不考虑盐的水解和溶液体积的变化)。①中溶液的pH为 :②中X电极质量改变量为
(5)z单质与水在一定条件下反应的化学方程式为 。
[答案]⑴ (2分)取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子。(2分)
(2分)取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子。(2分)
⑵K3PO4、H2O(2分)
⑶2Al+2OH-+2H2O = 2AlO2-+3H2↑(2分)
⑷2(2分)0.12g(2分)
⑸3Fe+4H2O Fe3O4+4H2↑(2分)
Fe3O4+4H2↑(2分)
[解析]U是突破口,因为其最高价氧化物对应水化物与其气态氢化物反应生成盐,U为氮元素,A为NH4NO3,U、V同主族,V为磷元素,V、M、X、Y处于同周期,且原子半径依次增大,四种元素在周期表中按 顺序依次排列,又因为U、W、Y最高价氧化物对应水化物之间能发生反应生成盐,所以W为铝,Y为钠,X在中间为镁。Z为血红蛋白中必需元素,Z为Fe。
顺序依次排列,又因为U、W、Y最高价氧化物对应水化物之间能发生反应生成盐,所以W为铝,Y为钠,X在中间为镁。Z为血红蛋白中必需元素,Z为Fe。
装置①为电解池,阳极Mg-2e-=Mg2+,阴极2H++2e-=H2,电路中通过电子0.01mol,有0.01molH+得电子被还原。c(H+)=(0.055*0.1*2)/0.1=0.01mol/L,溶液的pH=2
装置②为原电池,Mg为负极,发生反应Mg-2e-=Mg2+,电路中通过电子0.01mol,负极Mg减少0.01/2=0.005mol,质量减少0.005*24=0.12g。
Fe在高温条件下与水蒸气反应生成Fe3O4和H2。
15. 短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大。C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物
(1)写出E的单质与A、D两元素形成其常见化合物反应的离子方程式
________________________。
(2)由A、C、D三元素所形成的常见盐与氢氧化钠反应的方程式为_________________
(3)B的相对分子质量最小的氢化物,写出其化学式___________。
(4)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如下图:
|
|
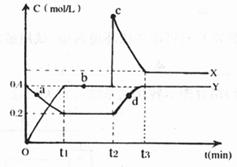
(I)X的化学式是___________
(II)图中a、b、c、d四点中,表示反应处于平衡状态的是___________
(III)反应进行到t2时刻,改变的条件可能是___________
[答案](1)2Na+2H2O=2Na++OH-+H2↑ (2分)(2)NH4NO3+NaOH=NaNO3+ NH3·H2O (2分)
(3)CH4(1分)(4)(I)NO2(1分)(II)b(1分)(III)增大NO2的浓度(合理)(1分)
[解析]先推测这5种元素,B的化合物种类繁多,数目庞大,B为碳元素,C、D是空气中含量最多的两种元素,所以C是氮元素,D是氧元素,D、E两单质可以生成两种不同的离子化合物,则E是钠元素,生成的两化合物为Na2O、Na2O2,根据五种元素的原子核外电子层数之和为10,得到A元素是H,(1)即为钠和水的反应:2Na+2H2O=2Na++OH-+H2↑;(2)A、C、D三元素所形成的常见盐为NH4NO3;(3)B的相对分子质量最小的氢化物是CH4(4)(I)由题意可知,两种氮的氧化物价态相同,则为NO2、N2O4.根据t1时刻的数据,△C(Y)=0.2mol·L-1,△C(X)=0.4mol·L-1,由反应:N2O4 2NO2,物质的量浓度的变化之比等于计量数之比,所以X是NO2,Y是N2O4(II)a、b、c、d四点中,b点时,两物质的浓度都没有变化,在平衡状态;反应进行到t2时刻,NO2的浓度迅速增大,然后逐渐减小,N2O4的缓慢增大,平衡向着生成N2O4的方向移动。改变条件为增大NO2的浓度
2NO2,物质的量浓度的变化之比等于计量数之比,所以X是NO2,Y是N2O4(II)a、b、c、d四点中,b点时,两物质的浓度都没有变化,在平衡状态;反应进行到t2时刻,NO2的浓度迅速增大,然后逐渐减小,N2O4的缓慢增大,平衡向着生成N2O4的方向移动。改变条件为增大NO2的浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com