
15.(10分)下图是目前世界上比较先进的电解法制烧碱技术-阳离子交换膜法的示意图。
(1)精制饱和食盐水从 口加入,从另一口加入水(含少量NaOH)。水中加入NaOH的作用是 ;制得的烧碱溶液从 口导出。
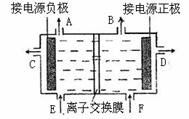 (2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入
试剂的合理顺序为 (填字母)。
a.先加NaOH,再加Na2CO3,最后加钡试剂;
b.先加NaOH,再加钡试剂,最后加Na2CO3;
c.先加钡试剂,再加Na2CO3,最后加NaOH。
(3)现有1000mL食盐水,用石墨电极电解。当阴极产生气体的体积为112mL(标准状况)时停止电解,阳极的电极反应式为_______________________,电解后,溶液在常温下的pH约为_____。
14.(2008.12东城区七所示范校第一次联考)(8分)
如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹,电源a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电, 电解一段时间后A、B中均有气体如图所示。
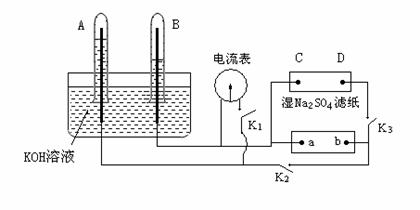
(1)电源的a极为 (填正、负极)。
(2)在湿的Na2SO4滤纸条中心滴KMnO4液滴,现象是 。
(3)写出A中电极反应式 。
(4)若电解一段时间后A、B中均有气体包围电极。此时切断K2、K3,闭合K1电流表的指针偏转,此时B极电极反应式为 。
13.(安徽省皖南八校2009届高三第一次联考化学试卷)(8分)
士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠粉术,使用时加入水与其中的镁反应放出热量。下面是在室温下对泼产品的两个探究实验:
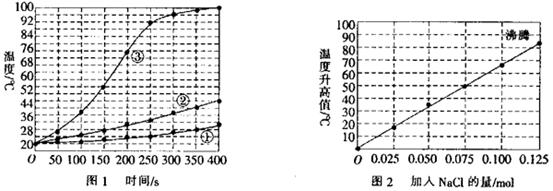
[实验I]向加有等量水的三个相同隔热容器中分别加入下列各组物质,结果参见下图l。
①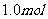 镁条、
镁条、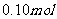 铁粉、
铁粉、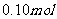 氯化钠粉末;
氯化钠粉末;
②将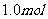 镁条剪成100份、
镁条剪成100份、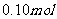 铁粉、
铁粉、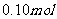 氯化钠粉末;
氯化钠粉末;
③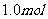 镁粉、
镁粉、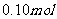 铁粉、
铁粉、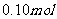 氯化钠粉末。
氯化钠粉末。
[实验2]向加有100 mL水的多个相同隔热容器中分别加入由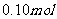 镁粉、
镁粉、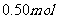 铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15 min时记录温度升高的幅度,参见上图2。
铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15 min时记录温度升高的幅度,参见上图2。
请同答下列问题:
(1)实验l证实了该反应的反应速率与 有关。
(2)实验2中当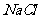 的用量大于
的用量大于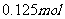 时,实验就无须再做的原因是 (填字母)。
时,实验就无须再做的原因是 (填字母)。
A.加入更多的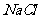 不再增加反应速率 B.加入
不再增加反应速率 B.加入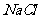 反而会降低反应速率
反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加人更多的铁粉来提高温度
(3)如果在实验2中加入了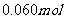 的
的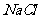 ,则第
,则第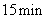 时混合物的温度最接近于
(填字母)。
时混合物的温度最接近于
(填字母)。
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、 能使反应速率加快的原因是
。
能使反应速率加快的原因是
。
12.(09海南卷 15)(10分)
15)(10分)
 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2
= 4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2
= 4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;
 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
11.(9分)如右图所示,水槽中试管内有一枚铁钉,放置数天后观察:
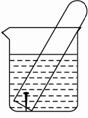
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,电极反应:负极: ,正极: 。
10.下列关于电解精炼铜的叙述中不正确的是 ( )
A.粗铜板体作阳极
B.电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-=Cu
C.粗铜中所含Na、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
D.电解铜的纯度可达99.95%-99.98%
9. 镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因而越来越成
为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为:
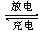 xMg+Mo3S4 MgxMo3S4
xMg+Mo3S4 MgxMo3S4
下列说法中错误的是 ( )
A.放电时Mg2+ 向正极迁移
B.放电时正极的电极反应为 Mo3S4
+ 2xe- == Mo3S42x-
C.放电时 Mo3S4 发生氧化反应
D.充电时阴极的电极反应为 x Mg2+
+ 2xe- == xMg
8.将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体 ( )
A.只有Cl2 B.只有O2 C.既有Cl2又有O2 D.只有H2
7.
 如图所示,a、b、c均为石墨电极,d为碳钢电极,
如图所示,a、b、c均为石墨电极,d为碳钢电极,
通电进行电解。假设在电解过程中产生的气体全部逸出, 下列说法正确的是
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为4OH――4e-=O2↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况)
6.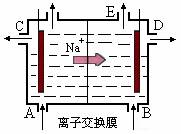 (浙江省2009届高三理科综合能力测试题)右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是
(浙江省2009届高三理科综合能力测试题)右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH
D.电解一段时间后加适量盐酸可以恢复到电解前的浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com