
5、为除去CO2气体中混有的少量杂质SO2气体,应选用的试剂是
A. 浓硫酸 B. 饱和NaHCO3溶液 C. 饱和NaOH溶液 D. 饱和Na2CO3溶液
4、下列物质能使品红溶液褪色的是
①Cl2 ②Na2O2 ③Ca(ClO)2 ④活性炭 ⑤SO2
A. ②③④⑤ B. ①②③ C. ①④⑤ D. 全都可以
3、 右图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是
右图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是
A.H2 B. NH3 C. CO D.SO2
2、有关亚硫酸的下列叙述中,不正确的是
A.亚硫酸是SO2的水溶液,显酸性 B.亚硫酸不稳定,容易分解为水和SO2 (
C.亚硫酸具有还原性,能被氧化成硫酸
D.亚硫酸对人体有害,所以用SO2漂白过的食品不能食用
1、检验SO2中是否含有CO2,应采用的方法是
A、通过澄清石灰水 B、先通过小苏打溶液,再通入澄清石灰水
C、通过品红溶液 D、先通过足量的酸性高锰酸钾溶液,再通入澄清石灰水
4、硫酸根离子的检验――基本原理是:SO42-+Ba2+=BaSO4↓
为排除某些干扰,其方法是:先在待测液中加入盐酸,以除去可能的CO32-、 SO32-、Ag+,然后再加入Ba2+即可检验待测液中是否有SO42-
[巩固练习]
2、浓硫酸的特性
(1)吸水性:将一瓶浓硫酸敞口放置在空气中,其质量将 ,密度将 ,浓度 。这是因为浓硫酸具有 性。利用这一性质在实验室里浓硫酸常用来作干燥剂,干燥 性和 性气体,如 ,不能干燥 性气体,如 ,和常温下具有还原性的气体,如
(2)脱水性:浓硫酸可以使有机化合物中的氢、氧元素按水的组成从有机物中“脱离”出来,结合成水分子,俗称“炭化”
(3)强氧化性
①跟金属反应:常温下,浓硫酸能使 等金属钝化。加热时,浓硫酸可以与绝大多数的金属反应,生成高价金属硫酸盐,本身被还原成SO2。
Cu + H2SO4(浓)
②跟非金属反应:热的浓硫酸可以将碳等非金属单质氧化到其高价态的氧化物,本身被还原成SO2。
C + H2SO4(浓)
1、硫酸是一种 色 状 体。硫酸是一种高沸点 挥发的 酸,易溶于水,能以任意比与水混溶。浓硫酸溶解稀释时放出大量的热。
5、SO2对大气的污染后果是形成 。导致酸雨形成的SO2主要来源于:一是
__ ___ 二是 ___ ___ _
4、漂白性
常用的漂白剂及其漂白原理:
SO2:与有机色质结合生成不稳定的无色化合物 活性炭:吸附作用(物理变化)
氯水、漂白粉、臭氧、过氧化钠、双氧水等:强氧化性
比较:品红溶液 现象:
现象:
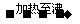 现象:
(
现象:
(
品红溶液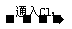 现象:
现象:
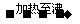 现象:
现象:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com