
2.请写出由S生成H2SO4的化学反应方程式。
1.讨论:考虑原料和成本等因素,你认为工业合成硫酸的途径如何?
22.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
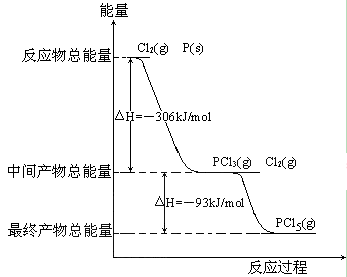
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1[分解率即分解量除起始量]等于_____ ____;。
(3) P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________。
21.氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436kJ·mol-1,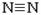 键能为945kJ· mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式:
键能为945kJ· mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式:
18. 某化学反应2A (g) ≒ B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
|
实验 序号 |
 浓度 浓度时间 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
1.0 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是 min,实验4达到平衡的时间是 min,C3 1.0 mol•L-1(填“ < ”、“ > ”或“ = ” )。
(2)实验4比实验1的反应速率 (填“快”或“慢”),原因是 。
(3)如果2A (g) ≒ B(g) + D(g) 是一个放热反应,那么实验4与实 验1相比, 放出的热量多,理由是 。
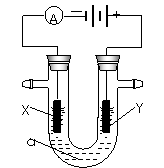 20电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
20电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
(3)若要在铁制品表面镀上一层银,则可选用 溶液为电解液,
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
17.完成下列表格的填写
|
电解对象 |
阳极反应式 |
阴极反应式 |
总反应式 |
|
氯化铜溶液 |
|
|
|
|
氢氧化钠溶液 |
|
|
|
|
盐酸 |
|
|
|
|
融熔氧化铝 |
|
|
|
|
硫酸钠溶液 |
|
|
|
16.(7分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是______________ ___________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,
与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是____________
___________________________________;所求中和热的数值会________(填“相等”
或“不相等”),理由是__________________________________________________。
890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+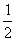 O2(g)=CO(g) △H= ―393.5 kJ/mol
O2(g)=CO(g) △H= ―393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H= ―2800 kJ/mol
厦门市杏南中学高二理科化学月考试题

[选择题答案填写处]
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷 (非选择题 共55分)
15.25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、
14.已知H2(g)+Cl2(g)=2HCl(g) △H=―184.6kJ·mol-1,
则反应HCl(g)=1/2H2(g)+1/2Cl2(g) 的△H为( )
A.+184.6kJ·mol-1 B. ―92.3kJ·mol-1 C. ―369.2kJ·mol-1 D. +92.3kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com