
由同种元素组成的性质不同的单质,叫做这种元素的同素异形体。如红磷和白磷都是由磷元素形成的单质,但常温下红磷在空气中能稳定存在而白磷在空气中能自燃(须保存在冷水中),红磷和白磷的完全燃烧产物都是五氧化二磷。白磷、红磷都是磷元素的同素异形体。在常见的元素中碳、氧、硫等也存在着同素异形现象,如,金刚石、石墨和富勒烯(C60、C70等)都是碳的同素异形体;O2、O3是氧的同素异形体。
例题2:下列说法中,正确的是
A. CO、CO2互为同素异形体
B. 碘晶体、碘蒸气是同素异形体
C. 同素异形体是同种元素的不同单质
D. 金刚石、石墨和富勒烯虽然性质差异较大,但在氧气中完全燃烧都生成二氧化碳且在一定条件下能相互转化
答案:CD
2.氮族元素性质比较:
在周期表中从上到下性质相似,最高价态为+5,负价为-3,Sb、Bi无负价;最高价氧化物水化物(HRO3或H3RO4)呈酸性。但非金属性逐渐减弱,金属性逐渐增强,从非金属元素逐渐过渡过金属元素。具体表现为:如氢化物的稳定性NH3>PH3>AsH3、最高价氧化物水化物的酸性HNO3>H3PO4等;这是由于它们的原子中最外层都有5个电子(性质相似),而在周期表中按从上到下的顺序电子层数逐渐增多(得电子能力逐渐减弱,失电子能力逐渐增强)引起的。
例题1:下列各项性质的递变规律错误的是
A. 沸点:NH3 > PH3 > AsH3 B. 非金属性:N > P > As
C. 还原性:AsH3 > PH3 > NH3 D. 酸性:HNO3 > H3PO4 > H3AsO4
答案:A
解析:根据氮族元素性质的递变规律,B、C、D均符合规律。NH3的式量最小,但氨分子间作用力最强,沸点比PH3高。
1.氮族元素:
包括氮(N)磷(P)砷(As)锑(Sb)铋(Bi)五种元素,最外层有5个电子,电子层数不同,是VA族元素。
11.某化工厂硫酸车间,为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后混合气体中含氧气的体积分数为11%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失。问该厂生产100 t 98%的硫酸需要消耗标准状况下空气多少m3。
10.以黄铁矿为原料,用接触法制硫酸。黄铁矿煅烧时FeS2的利用率为90%,SO2的转化率为95%,SO3吸收为H2SO4时的损耗率为2%,。现有含70% FeS2的黄铁矿1 t,可生产98%的硫酸多少t?
D.奥赛一瞥
9.以下可逆反应中,达到平衡后,通过升高温度可提高反应物转化率的是 ;通过增大压强可提高反应物转化率的是 ;改变压强,转化率不变的是 。
①A(s)+B(g) 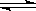 C(g), ΔH < 0;
C(g), ΔH < 0;
②N2(g)+3H2(g) 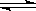 2NH3(g), ΔH < 0;
2NH3(g), ΔH < 0;
③2NO2(g) 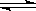 2NO(g) +O2(g),ΔH > 0;
2NO(g) +O2(g),ΔH > 0;
④2SO2(g)+O2(g)
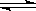 2SO3(g) ,ΔH < 0。
2SO3(g) ,ΔH < 0。
⑤CO(g)+NO2(g)
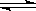 CO2(g) +NO(g),ΔH < 0;
CO2(g) +NO(g),ΔH < 0;
8.冶金工业上为降低硫的氧化物对空气的污染,常用CO在500℃、铝矾土催化下还原SO2,处理烟道废弃回收硫,写出该反应的化学方程式 。
7.硫酸工业常用 收SO3,是为了避免 ;在生产过程中为了提高原料的利用率,常用 、 。
6.在一定条件下,某密闭容器发生如下反应:2SO2(g)+O2(g) 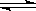 2SO3(g)
, H= -98.3kJ/mol,反应达到平衡后SO2、O2、SO3的物质的量之比为3:2:5,保持其它条件不变,升温后重新达到平衡,SO3、O2的物质的量分别为2α mol和α mol,则此时容器内SO2的物质的量应为
( )。
2SO3(g)
, H= -98.3kJ/mol,反应达到平衡后SO2、O2、SO3的物质的量之比为3:2:5,保持其它条件不变,升温后重新达到平衡,SO3、O2的物质的量分别为2α mol和α mol,则此时容器内SO2的物质的量应为
( )。
 A.
mol B.
mol C.
mol
D. mol
A.
mol B.
mol C.
mol
D. mol
C.能力训练
5.接触法制硫酸生产过程中,假如进入接触室的原料气为100m3,反应后体积减少为92m3,已知原料气中SO2、O2、N2的体积比为20:15:65,则SO2的转化率为 ( )。
A.90% B.80% C.70% D.60%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com