
14.常温下,某饱和石灰水的PH=12,密度为dg/cm3,则该温度下Ca(OH)2的溶解度为( )
 A.
B..
C. D.
A.
B..
C. D.
13.将标准状况下体积为224 mL的Cl2通入到25.00 mL 0.1 mol · L – 1 Na2S2O3溶液中恰好完全反应,此时Cl2全部转化为Cl –,则S2O32-转化为( )
A.SO42- B.SO32- C.S D.S2 -
12.运用元素周期律分析下面的推断,①铍(Be)的氧化物的水化物可能具有两性,②铊(Tl)既能与盐酸作用产生氢气,又有跟NaOH溶液反应放出氢气,Tl(NO3)3溶液的酸性很强,③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀硝酸,④锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱,⑤硫酸锶(SrSO4)是难溶于水的白色固体,⑥硒化氢(H2Se)是无色,有毒,比H2S稳定的气体。其中错误的是:( )
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
11. X、Y、Z为短周期元素,X原子的最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的三倍。下列有关叙述正确的是( )
A.X、Y、Z三种元素可形成化合物X3YZ4
B.X、Y两元素形成的化合物只可能为离子晶体
C.Y、Z 两元素形成的化合物熔点较低
D. Y的氢化物的稳定性大于Z的氢化物的稳定性
10.对于下列离子的检验与结论正确的是( )
A.加稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液一定有CO32-
B.加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42-
C.加氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,原溶液一定有NH4+
D.加碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,原溶液一定有Ba2+
9. 下列实验操作正确的是( )
A.将氢氧化钠固体放在滤纸上称量
B.用10mL量筒量取8.86mL盐酸
C.配置0.1mol/L的硫酸溶液时,将量取的浓硫酸放入容量瓶中加水稀释
D.配置氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
8.下列离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2: MnO2+2H++2Cl-=Cl2↑+Mn2++H2O
D.漂白粉溶液中通入过量的二氧化碳: Ca(ClO)2+2H2O+2CO2=Ca2+ + 2HCO3-+2HClO
7.下列各组离子在指定条件下,一定能大量共存的是( )
A.PH为1的无色溶液:K+、Fe2+、SO42-、NO3-、Cl-
B.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br-
C.水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl-
D.加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、NO3-
6.同温同压下,下列各组热化学方程式中,△H1﹤△H2的是( )
A.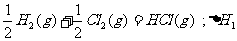
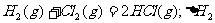
B.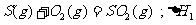
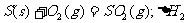
C.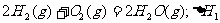

D.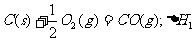
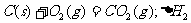
5.关于晶体的下列说法正确的是( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.晶体中分子间作用力越大,分子越稳定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com